(14分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物为 , 所含的化 学键类型为 。
学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题: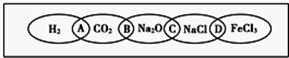
(1)请将分类依据代号填入相应的括号内:
()两种物质都不是电解质
()两种物质都是钠的化合物
()两种物质都是氧化物
()两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是_______________________________________。
(Ⅰ)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
①.除去NaOH溶液中悬浮的CaCO3;②.从溴水中提取溴;
③.用自来水制取蒸馏水;④.与海水晒盐原理相符的是。
(Ⅱ)某化学课外小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗上口的小孔;
H.静置、分层。
就此实验完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
________→________→________→A→________→G→E→F。
(2)上述G步骤操作的目的是_________________________________________________。
在氧化还原反应中,氧化剂电子,发生的反应是反应;
还原剂电子,发生的反应是____________反应。
铁与氯气反应的化学方程式为,生成物中铁是价,铁与盐酸反应的离子程式为,生成物中铁是_____价。
电解质是指在 ___里或熔融状态下能够导电的。电解质导电的根本原因在于它在这种状态下能够出自由移动的离子。科学家从这个角度对化合物进行了分类,根据这种分类,酸、碱、盐应该属于。
在 500 mL 2 mol/L NaOH溶液中,NaOH的摩尔质量为g/mol,溶质的质量是g,此溶液中含 Na+的物质的量是mol,Na+的物质的量浓度是mol/L