在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。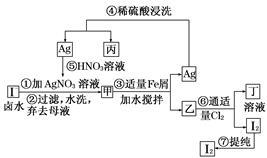
试回答下列问题:
(1)乙、丁中溶质的化学式:乙:________,丁________。
(2)第④步操作中用稀硫酸浸洗的目的是________(填写字母编号)。
| A.除去未反应的NO | B.除去未反应的I- |
| C.除去未反应的Fe | D.除去碱性物质 |
(3)第⑦步操作可供提纯I2的两种方法是________和________(不要求写具体步骤)。
(4)实验室检验I2的方法是___________________________________________________。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)__________________。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是_____________________________(填元素符号)。
(2)由这五种元素组成的一种化合物是_______________________________(写化学式)。
(3)写出D元素基态原子的最外层电子排布图__________________________________。
(4)元素电负性为B_______D,元素第一电离能为C______E(填“﹥”、“﹤”或“﹦”)
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析: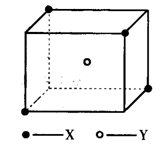
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
二氧化硅晶体是立体的网状结构,其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1) 二氧化硅是一种晶体。
(2) 二氧化硅晶体中最小的环为元环。
(3) 每个硅原子周围有个氧原子。
下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。
(1) 根据各图表示的结构特点,写出该分子的化学式:
A:________ B:_________ C:________ D:________
(2)与D互为等电子体的化学式
用VSEPR 理论判断:
| 物质 |
孤对电子对数 |
轨道杂化形式 |
分子或离子的形状 |
| NH4+ |
|||
| NCl3 |