(8分)(1)给下列方程式配平,用双线桥标电子转移方向和数目
MnO2 + HCl(浓) = MnCl2 + Cl2↑ + H2O 当发生转移的电子物质的量0.5摩时,被氧化的HCl物质的量为 。
(2)亚铁盐容易与空气中的氧气发生氧化还原反应而变质,在配制亚铁盐溶液时往往要加入适量的铁粉防止变质,氧气在亚铁盐变质中做为 (填氧化剂或还原剂,下同),加入铁粉在防止变质时是做为 。
(本题共12分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→ (C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
32.第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式________;充分反应后CaCO3固体需有剩余,目的是______________________;
33.第③步需趁热过滤,原因是______________________;
34.第④步加入乙醇的作用是______________________;
35.第⑥步中,下列洗涤剂最合适的是________。
A.冷水B.热水C.乙醇D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用。工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
步骤1:充分反应后,过滤除去CaSO4沉淀。步骤2:将葡萄糖酸溶液与ZnO混合。
36.步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是。
37.下列物质可替代ZnO的是(填字母)。
a.NH3·H2O
b.Zn(OH)2
c.NaOH
d.ZnSO4
e.ZnCO3
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为,其原子核外能量不同的电子有种,最外层上有种不同运动状态的电子,钙元素在元素周期表中位于。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物?(填“是”或“否”)。甲的化学式是。
30.写出甲与水反应得H2的化学方程式。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是。
(本题共12分)合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
23.氨分子的电子式为_________,氮元素原子最外层电子排布的轨道表示式是________。
24.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
根据上图,计算从反应开始到平衡时,氢气的平均反应速率为___________________。
25.催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:;该反应中氧化产物与还原产物的物质的量之比为。
26.pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
27.氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为。该工艺选择氯气的优点是。(答出一点即可)
(本题共12分)已知: (X为卤原子,M为烃基或含酯基的取代基等)
(X为卤原子,M为烃基或含酯基的取代基等)
由有机物A合成G(香豆素)的步骤如下: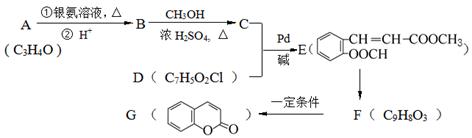
回答下列问题:
47.写出反应C+D→E的反应类型 。
48.A中官能团名称为;写出反应条件:E→F。
49.写出结构简式:B,D。
50.F有多种同分异构体,写出同时满足下列条件的任意两种同分异构体的结构简式:。
① 分子中除苯环外,无其它环状结构;
② 分子中有四种不同化学环境的氢原子;
③ 能发生水解反应,不能与金属钠反应;
④ 能与新制Cu(OH)2按物质的量之比1:2反应。
51.二氢香豆素(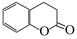 )常用作香豆素的替代品。鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品。鉴别二氢香豆素和它的一种同分异构体(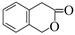 )需要用到的试剂有:NaOH溶液、。
)需要用到的试剂有:NaOH溶液、。
52.已知: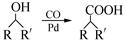 (R,R′为烃基)。试写出以苯和丙烯(
(R,R′为烃基)。试写出以苯和丙烯( =CH—CH3)为原料,合成
=CH—CH3)为原料,合成 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下:
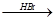
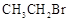



(本题共10分)许多有机化合物中都含有N元素。
43.无色油状液体苯胺(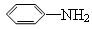 )是最简单的芳香胺,暴露于空气中变为棕色,该变化最有可能与苯胺具有相关(选填编号)。苯胺可以由苯经过两步反应生成,写出第一步反应的化学方程式、第二步反应的类型为。
)是最简单的芳香胺,暴露于空气中变为棕色,该变化最有可能与苯胺具有相关(选填编号)。苯胺可以由苯经过两步反应生成,写出第一步反应的化学方程式、第二步反应的类型为。
a.酸性 b.碱性 c.还原性 d.氧化性
44.尼龙可以由1,6-己二酸与H2NRNH2在一定条件下合成。写出反应的
化学方程式:。
45.分子式为C3H9N的有机物有种可能的结构。
46.普拉西坦是一种改善记忆、抗健忘的中枢神经兴奋药,其结构如图。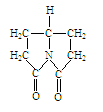
写出该有机物在酸催化下水解产物的结构简式。