(15分)2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0. 9 9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是____▲___;
(2)根据你的理解,元素的电负性指_____▲__ ;
(3)预测Br和I元素电负性的大小关系▲。
有A、B、C、D四种元素,其原子序数大小关系为A>B>C>D。已知:将0.5 mol A元素的最高价离子还原成中性原子时,需得到6.02×1023个电子。当A的单 质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
质同盐酸充分反应时可放出0.02 g氢气,用去0.4 g A单质。B元素原子的核外电子层数和A相同,并知B元素的原子半径比A大。C元素形成的氧化物既能溶于强酸,也能溶于强碱。D元素与氢气生成的化合物的化学式为DH3,其最高价氧化物中氧元素的质量分数为74.07%。试回答:
(1)元素符号:A___▲__,B___▲__,C__▲___,D__▲__。
(2)鉴定某物质中含有B元素的最简单的实验是__▲__。
(3)A、B、C三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(用化学式表示)__▲____。
某元素的同位素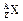 ,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核
,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核 内有20个中子,求:
内有20个中子,求:
(1)Z值 ▲和A值 ▲;
(2)X元素在周期表中的位置 ▲;
(3)写出XCl2的电子式▲。
已知有关物质的熔、沸点数据如下表:
| MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
| 熔点(℃) |
2852 |
2045 |
714 |
190(2.5×105Pa) |
| 沸点(℃) |
3600 |
2980 |
1412 |
177.8 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁;用电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因是:___▲____; AlCl3可能为___▲____晶体。
(2)请设计可靠的实验证明MgCl2、AlCl3所属化合物的类型,其实验方法是_____▲____ 。
(3)AlCl3具有以下__▲__特殊性质(请填序号)。①液化②挥发③升华
有下列四种微粒: ①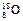 ,②
,②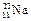 ,③
,③ ,④
,④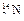 。(填序号)
。(填序号)
(1)微粒中质子数小于中子数的是____▲___。
(2)在化合物中呈现的化合价的数值最多的是__▲_。
(3)能形成X2Y2型化合物的是__▲____,电子式为▲;能形成X3Y2型化合物的是___▲____。