早在西汉时期,我国就用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”。
(1)请写出“湿法炼铜”的化学方程式 。
(2)若用该方法制得铜32 g,反应的铁的质量为 g,若同时消耗了500 g硫酸铜溶液,则该硫酸铜溶液中硫酸铜的质量分数为 %。
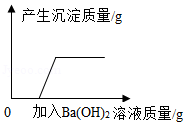
某溶液含有HCl、Na2CO3、H2SO4、MgCl2中的两种溶质,向该溶液中加入Ba(OH)2溶液,产生沉淀质量与加入Ba(OH)2溶液质量的关系如图所示。则该溶液中的溶质是 。
干粉灭火器在我们身边随处可见,常见的一种ABC型灭火器内充装物的主要成分是磷酸二氢铵(NH4H2PO4),使用时,磷酸二氢铵受热分解,产生有剌激性气味的氨气(NH3),同时生成两种常见的氧化物,试写出磷酸二氢铵受热分解的化学方程式 。
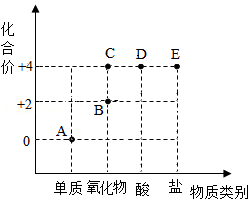
小强是个爱思考的同学,他以化合价为纵坐标,以物质类别为横坐标绘制图象,这种图象叫价类图。如图是有关碳的价类图,请你分析并回答问题:
(1)B点表示的物质的化学式为 。
(2)二氧化碳代表的点是 。(选填“A~E”)
2019年5月17日,80t液氧甲烷发动机﹣﹣“天鹊”20s试车在浙江湖州圆满成功。液氧甲烷发动机是以液氧为氧化剂,甲烷为燃料的液体火箭发动机。请写出液氧甲烷发动机中发生反应的化学方程式 。
中央电视台暑期推出的科学类节目《加油!向未来》将科学知识融合到节目中,深受广大学生喜爱。请你参与节目回答问题:
(1)人体内含量最多的微量元素是钙还是铁? ;
(2)炒菜时油锅中的油不慎着火,可以采取的灭火方法是 ;
(3)用厨房中的白醋浸过的白色纸花,喷上一种试剂后,变成漂亮的红色小花,这种试剂是 。