铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: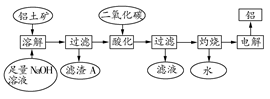
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 。
(2)滤渣A的主要成分为 ;滤渣A的用途是 (只写一种);实验室过滤时使用玻璃棒,其作用是 。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是 。
(4)若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是 。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;该气化气可在适当温度和催化剂下合成液体燃料甲醇,该反应方程式为 。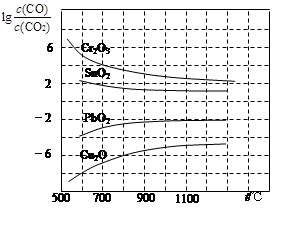
(3)CO常用于工业冶炼金属,右下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。
下列说法正确的是 。
| A.工业上可以通过增高反应装置来延长矿 石和CO接触的时间,减少尾气中CO的含量 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有 利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
(4)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
(5)将CO通入银氨溶液中可析出黑色的金属颗粒,写出反应方程式 。
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
|
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
PbI2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如下: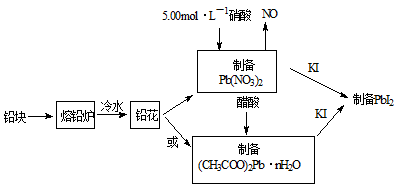
(1)将铅块制成铅花的目的是 。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸 mL,同时产生 L(标准状况下)NO。
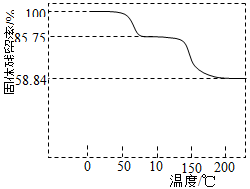
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率( )随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n= (填数字)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为 (写结构简式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。计算室温时PbI2的Ksp (请给出计算过程)。
丹参酮ⅡA是一种治疗心血管疾病的药物,其中的一种合成路线如下: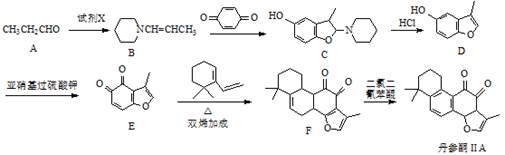
(1)丹参酮ⅡA中含氧官能团为 和 (写名称)。
(2)试剂X的分子式为C5H11N,则X的结构简式为 。
(3)A→B的反应类型为 、 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.能发生银镜反应
Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢
(5)写出以CH3CH=CHCH3和CH2=CHCHO为原料制备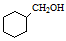 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
CH3CHO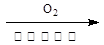 CH3COOH
CH3COOH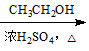 CH3COOCH2CH3
CH3COOCH2CH3