铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生产中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中含有的大量阳离子是________。
(2)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下所示。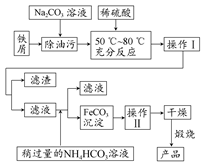
回答下列问题:
①操作Ⅰ所用的分离仪器的名称是________;操作Ⅱ的名称是________,该操作的具体方法是________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________。
③请写出生成FeCO3沉淀的离子方程式:________。
(8 分)下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,L是水,D是淡黄色固体,E为单质。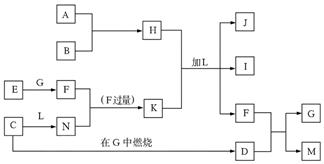
试填写下列空白:
(1)写出F的化学式: _______________。
(2)写出M发生水解的化学反应方程式__________________。
(3)反应C+G→D的化学方程式是_______________。
(4)写出H 、K加L生成J、I、F反应的离子方程式_______________。
下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
(1)以上10种元素的原子中,最容易失电子的是(填写元素符号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是、(写分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式。
(选做题)(物质结构与性质)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式,写出一种含非极性键的离子化合物的电子式。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是,
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为晶体。
(选做题)(有机化学)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为:
(1)用没食子酸制造墨水主要利用了___________________类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸丙酯且有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为________________________________________________。
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_________________________,其苯环只与-OH和-COOR两类取代基直接相连的同分异构体有___________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:
_____________________________________________________________
长期以来,人们一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO以来,对HFO的研究引起了充分重视。
(1)HFO的化学名称为
(2)HFO能与水发生反应:HFO+H2O=HF+H2O2,其中氧化剂是;
(3)写出F2与水发生发应的化学方程式,并用双线桥法标出该反应中电子转移的方向和数目: