下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: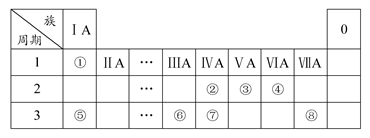
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) ;
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为 。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为 。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应: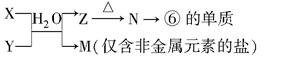
①X溶液与Y溶液反应的离子方程式为 ;
②N→⑥的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
(15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):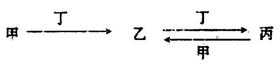
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
A.3:2 B.4:1 C.5:1 D.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
A.NaOH溶液 B.CaC12溶液 C.稀硫酸 D.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示: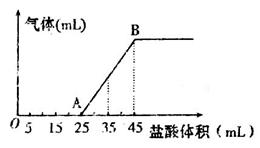
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22mL(标准状况),则盐酸的物质的量浓度为_______。
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为____________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
A.测两种元素单质的硬度和熔、沸点 B.测等浓度相应氯化物水溶液的pH
C.比较单质与同浓度盐酸反应的剧烈程度 D.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,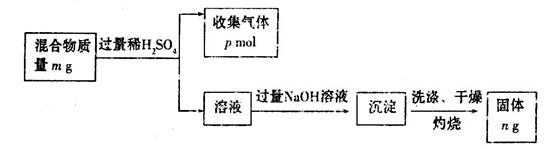
测定该混合物中Z的质量分数。能确定混合物中Z的质量分数的数据组有_________(填代号)。
A.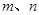 B.
B.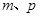 C.
C.
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。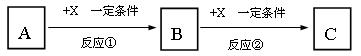
试回答:
(1)若X是强氧化性单质,则A不可能是________________。
A S B N2 C Na D.Mg E.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为_________;C溶液在贮存时应加入少量X,理由是________________________,(用必要的文字和离子方程式表示)检验此C溶液中金属元素价态的操作方法是____________________________。
(3)若A、B、C为含有金属元素的无机化合物,X为强酸或强碱,A溶液与C溶液反应生成B。反应①的离子方程式可能为____ ___________或____________________________。
(6分)某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此推断:
(1)原溶液中一定不存在
(2)100mL溶液中c(SO42‑)=
(3)原溶液中除Fe3+、SO42-外,一定大量存在的离子有