某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。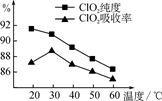
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O
14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为:。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为:。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
(15分)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。 NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:A.石灰石 B.生石灰 C.6mol/L盐酸 D.稀硫酸 E.浓氨水 F.饱和氯化钠溶液。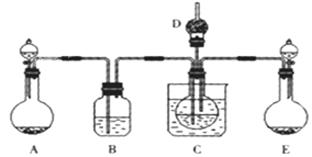
①A中制备气体时,所需药品是(选填字母代号);
②B中盛有饱和碳酸氢钠溶液,其作用是;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为;
④E装置向C中通气的导管不能插入液面下的原因是。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为、、;
③所得晶体中碳酸氢钠的纯度为。
(14分)常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO 、SO
、SO 、CO
、CO 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含的阴离子相同的两种盐的化学式是________。
(2)D的化学式为________,D溶液显碱性的原因是(用离子方程式表示)_________________。
(3)A和C的溶液反应的离子方程式是_____________________。
E和氨水反应的离子方程式是_______________________。
(4)若要检验B中所含的阳离子,正确的实验方法是_____________________
(14分)(1)用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
①配制稀盐酸时,应选用容量为______mL的容量瓶;
②经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的______。
| A.5ml | B.10mL | C.25mL | D.50mL |
(2)若某药品质量约为32.0 g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下。
| 50 g |
20 g |
20 g |
10 g |
5 g |
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度。
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度。
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度。