A的分子式为C2H6O2,以A为原料,按下图所示流程合成一种常用的光敏高分子材料G,其结构简式为: 。
。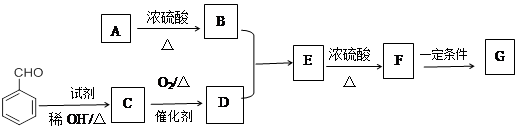
已知:①—CH2OH+—CH2OH —CH2OCH2—+H2O
—CH2OCH2—+H2O
②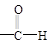 +
+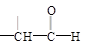
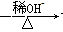
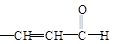 +H2O
+H2O
请回答下列问题:
(1)A的名称是 :F—→G的反应类型是
B的核磁共振氢谱上共有 种吸收峰。
C的结构简式是 。
A—→B的化学方程式是 。
B+D—→E的化学方程式是 。
写出同时满足下列条件的D的所有同分异构体的结构简式:
①属于酯类且苯环上只有一个取代基 ②除苯环外不再含其他环状结构
目前,我省多地正在积极推广使用太阳能。常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能(947kj • mol-1)大于碲(941 kj • mol-1)。请从原子结构的角度加以解释_________。
(3)As2O3俗名砒霜,是一种剧毒物质。法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷镜”,这就是著名的“马氏验砷法”。请用化学方程式表示检验原理:
__________________、__________________
(4)硼酸(H3BO3)在水溶液中易结合一个OH—生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________。
②[B(OH)4]-的结构式为____________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______ (用化学式表示
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。
立方氮化硼晶胞中含有______个氮原子、______个硼原子,立方氮化硼的密度是______g • cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
高铁酸钾(K2Fe04)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
已知:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是____________。
(2)写出工业上制取Cl2的化学方程式____________。
(3)在“反应液I”中加入KOH固体的目的是____________。
(4)K2FeO4可作为新型多功能水处理剂的原因是____________。
(5)配制KOH溶液时,将61.6g KOH固体溶解在100 mL水中,所得溶液的密度为1.47 g • mL-1,则该溶液的物质的量浓度为____________。
(6)从“反应液II”中分离出K2Fe04后,副产品是___________ (写化学式)。
(7)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为______mol。
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。
①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g)△H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g)△H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时负极电极反应式可表示为______。
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将冰铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L‑1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 • 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。
请确定110°C时固体物质的化学式____________。(要求写出推断过程)
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为,SO2—4的立体构型是,其中S原子的杂化轨道类型是。
(3)N、O、F三种元素的电负性由大到小的顺序为,Cu2O的熔点高于Cu2S,请解释原因:。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为[列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。