D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: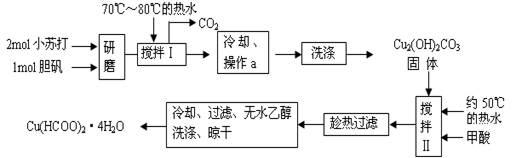
回答下列问题:
(1)生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为。
(2)操作a的名称是,该操作使用的玻璃仪器有。
(3)证明碱式碳酸铜沉淀已经洗涤充分的实验操作是;“趁热过滤”的原因是;
(4)用无水乙醇洗涤晶体的目的是。
铝土矿的主要成分是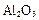 ,还含有
,还含有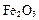 、
、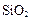 等杂质。
等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: 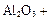
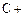
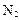

 CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法: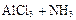


(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
市售氯化钾中所含杂质以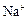 和
和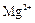 为主,也含有少量
为主,也含有少量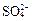 、
、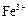 等。提纯过程如下:
等。提纯过程如下: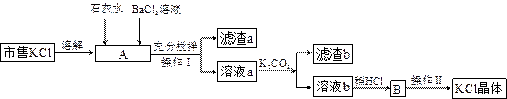
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣b的主要成分是 。
(3)检验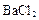 溶液是否加入过量,其详细操作过程为 。
溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是 ,进一步提纯的方法是 。
【化学—有机化学基础】
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2;有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。请回答下列问题:
(1)C的结构简式是 ______________________;
(2)有机物B在Cu作催化剂的条件下与O2 反应生成D,有机物E是D的氧化产物,F是E的一种同分异构体,F可发生如下图所示的转化,其中Y的分子式为C6H8O4且分子中含有一个由六个原子构成的环。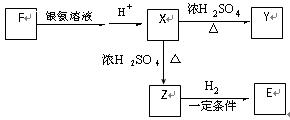
①写出F的结构简式_____________________;
②写出由X生成Y的化学方程式________________________________________;
③Z在一定条件下可以聚合生成高分子化合物,写出化学方程式 。
【化学—物质结构与性质】
第四周期的Cr 、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: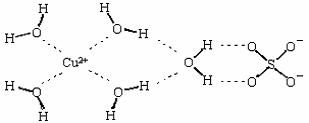
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |