Ⅰ.下列说法中正确的是 。
| A.SO2和O3、PO43-和ClO4-互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线形分子 |
E.CH4、BCl3、CO2都是含有极性键的非极性分子
Ⅱ.立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
(2)如图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3(只要求列出算式)。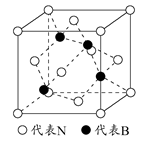
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因: 。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
(8分)某有机物的结构简式为HO-CH2—CH=CH—CH=CH-CHO。
(1)请你写出下列官能团
“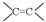 ”、“HO-”、“-CHO”的名称: 、 、。
”、“HO-”、“-CHO”的名称: 、 、。
(2)验证该有机物中含有“-CHO”,常采用的试剂是 ,产生的现象为 。
(3)该有机物的性质描述正确的有
| A.与金属Na反应放出O2 | B.能与新制Cu(OH)2反应,产生红色沉淀 |
| C.不能发生银镜反应 | D.一定条件下能与H2发生加成反应 |
(4)1mol该有机物完全与溴水发生加成反应时,需要Br2mol
(9分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子分子,原子间存在3对共用电子对 |
| X |
M层有3个电子 |
| Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
| Z |
最低负价为—2价,且无最高正价 |
用化学符号回答以下问题:
(1)比较:氢化物的稳定性:TZ,最高价氧化物对应水化物的酸性:TY。(填“>”、“<”或“=”)
(2)Y元素位于元素周期表中第周期,第族。
请你设计一实验方案,证明X的氯化物是离子化合物还是共价化合物。简要写出实验内容、现象和结论。。
(3)X的最高价氧化物对应水化物与烧碱反应的离子方程式为:。
(4)T、X、Y、Z四种原子的半径由大到小的顺序为:。
(7分) 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则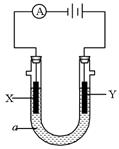
(1)电解过程中反应的总化学方程式为;
X极附近观察到的现象是 ___。
(2)Y电极上的电极反应式为 ________________;
检验该电极反应产物的方法是 _________。
(6分)按要求填空: (1)
(1) 与Ne原子电子层结构相同的
与Ne原子电子层结构相同的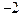 价阴离子,填写微粒的结构示意图:_____;
价阴离子,填写微粒的结构示意图:_____; (2)用电子式表示两核10电子的共价化合物形成过程:;
(2)用电子式表示两核10电子的共价化合物形成过程:; (3)在1~18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(3)在1~18号元素中,气态氢化物的水溶液呈碱性的化合物的结构式:__________ 。
(4)相对分子质量为58的烷烃的分子式是_______________,
它可能的结构简式是___________________________________________________
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+KI+H2SO4=K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg。