(15分)已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X2+Y2→甲,X2+W2→乙,甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是 ;甲的空间构型为 。
(2)丙的水溶液呈酸性,用离子方程式 表示其原因 。
表示其原因 。
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,
写出丁在水中的电离方程式 ;X、Y组成的液态化合物Y2X4 16克与足量丁反应生成Y2和液态水,放出Q kJ的热量,请写出该反应的热化学方程式
Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为 。
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)=mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g)△H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g)△H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是。
A.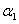 + + =1 =1 |
B.2 = = |
C.a+b=14.9 | D.c1=c2=c3 |

(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为 。
。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g)△H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g)△H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式: 。
。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式: MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g) 2SO3(g)△H< 0反应。该反应的化学平衡常数K=(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是(填序号)。
2SO3(g)△H< 0反应。该反应的化学平衡常数K=(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是(填序号)。
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图;
F元素氧化物的晶体类型为。
(2)比较B、C、D元素简单离子半径的大小:>>(填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因:;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式:,该阳离
子中存在的化学键有,并写出该阳离子与F氢化物的水溶
液反应的离子方程式:。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为mol·L-1。
现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
| 组序 成分 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 残留固体成分 |
[ |
|||||
| 溶液中金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
现有浓度各为2 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,无固体存在,则溶液中一定含有的金属阳离子是。
(2)反应完毕后,铁粉有剩余,过滤所得的固体物质为,溶液中一定含有的金属离子的物质的量为mol。
(3)反应完毕,有固体剩余,则反应后的溶液中一定有的金属阳离子为,其物质的量取值范围是。