一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型是 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1 mol CO2中含有的σ键数目为 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,生成4mol z时放出热量Q KJ, 它们的物质的量随时间的变化如表所示。
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
(1)根据上表中数据,在答卷该题相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2) 写出体系中发生反应的热化学方程式 ______;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:
(4) 该反应达到平衡时反应物X的转化率 等于______________________;
等于______________________;
(5) 改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1 _____2_____3_____的曲线:
实验室常利用甲醛法(HCHO)测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+消耗NaOH与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500 g。
步骤II将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
滴定时消耗NaOH标准溶液的体积的平均值V="__________mL;" 若NaOH标准溶液的浓度为0.1010 mol·L-1,则250 mL溶液中的n(NH4+)=__________mol,该样品中氮的质量分数为______。
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
| ①号试管 |
②号试管 |
|
| 加入药品 |
草酸溶液 硫酸酸化高锰酸钾溶液 |
草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) |
溶液褪色很慢(30s) |
溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1 mol·L-1的高锰酸钾溶液。现象如下(表2)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 现象 |
100 s |
90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
| 编号 |
①号试管 |
②号试管 |
③号试管 |
| 褪色时间 实验现象 |
80 s |
100 s |
120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1)该研究性学习小组的实验目的是。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫法;
(3)实验(1)得出的结论是。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+MnO4—+ =Mn2++ + H2O
现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下: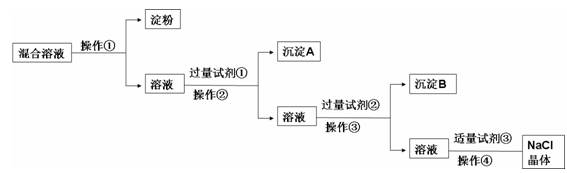
(1)a.操作①是利用胶体中胶体粒子______________(填“能”或“不能”)透过半透膜,溶液溶质分子、离子__________(填“能”或“不能”)透过半透膜进行分离提纯。
b.如何用实验证明淀粉未透过半透膜而Cl-已透过半透膜:
______________________________________________________
___________________
(2)写出上述实验过程中所用试剂:
试剂①_______________________;试剂③________________________。
(3)判断试剂①已过量的方法是:________________________________________。
(4)用化学方程式表示加入试剂②的作用:
____________________________________________________________________
(5)操作④的名称是__________________________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用
(1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);使用 催化剂后反应的△H(填“增大”“减小”或“不改变”)。
催化剂后反应的△H(填“增大”“减小”或“不改变”)。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应: 2 N2O5(g)4NO2(g)+O2(g)△H>0
2 N2O5(g)4NO2(g)+O2(g)△H>0
①下表为反应T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内 N2O5的分解速率为。
N2O5的分解速率为。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2T1(填
“>”“<”“=”)
(3)已知肼分子(H2N—NH2)可以在 氧气中燃烧生成氮气和水。
氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g)△H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼。说明原因。