碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞实验,震荡.
现象:溶液变成浅红色.由此得出结论 ;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为 ;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如图所示装置进行实验
现象:充分加热后,大试管口有. 出现,管底有白色固体残留,
小试管中的现象. .
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).
| 步骤 |
现象 |
结论 |
| 取样于试管中,往试管中滴加 |
|
|
(2)写出碳酸氢钠受热分解的化学方程式 ;
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 .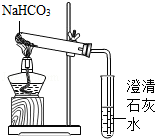
(5分)Ti是一种重要的航天金属材料。某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究。过程如下:
【提出假设】a.Ti金属活动性比Al强。 b.Al金属活动性比Cu强。
【查阅资料】钛能与盐酸反应。
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。
【操作分析】三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是。
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
【实验现象】
| 金属 |
Ti |
Al |
Cu |
| 与盐酸反应现象 |
反应缓慢 |
反应剧烈 |
无明显现象 |
【实验结论】(1)原假设中不正确(填“a”、“b”或“a与b”)。
(2)三种金属的金属活动性由强至弱的顺序为。
【结论应用】能否用铝制容器来盛装波尔多液(含硫酸铜),(填“能”或“否”);理由是。
(7分)小明同学利用一瓶敞口放置已久的NaOH溶液进行了一些实验探究。
【提出问题】这瓶NaOH溶液变质程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质。
【实验探究】小明设计如下实验来验证自己的猜想,请根据表中内容填写小明实验时的现象:
| 实验步骤 |
实验现象 |
结论 |
| (1)取样,滴加足量的CaCl2溶液。 |
产生白色沉淀。 |
NaOH溶液部分变质。 |
| (2)过滤,向滤液中滴加几滴无色酚酞试液。 |
【实验反思】下列物质①Ca(OH) 2溶液、②Ba(NO3)2溶液、③BaCl2溶液,能替代小明实验中CaCl2溶液的
是(填序号)。
【拓展应用】通过实际实验,确认这瓶放置已久的NaOH溶液部分变质。现从该瓶中取了100g 溶液,向其中逐滴加入11.1%的CaCl2溶液,产生沉淀质量与所加CaCl2溶液质量的关系如图所示。
(1)A点处所得溶液中溶质有。
(2)求待测溶液中Na2CO3的质量分数。( 写出计算过程)
呼吸面具中的“氧气再生剂”,主要成分是淡黄色固体过氧化钠(Na2O2),使用后变成白色固体。某兴趣小组对白色固体的成分进行了探究。
【作出猜想】根据呼出的气体中含有较多的和 ,作出如下猜想:
猜想一:白色固体中一定含有氢氧化钠
猜想二:白色固体中一定含有碳酸钠
猜想三:白色固体中一定含有氢氧化钠和碳酸钠
【实验验证】
(1)小明取少量水溶解白色固体,然后滴加酚酞溶液,溶液变红色。于是小明认为猜想二一定不正确。同学们认为小明的实验不能得出正确结论,因为。
(2)小红另取少量白色固体,滴加少量稀盐酸,没有观察到有气泡产生,于是小红认为白色固体中一定不含有碳酸钠,并得出结论只有猜想一正确,猜想二和猜想三都不正确。同学认为小红的实验也不能得出正确结论,因为。
(3)小玉另取少量白色固体用适量的水溶解。依次滴加足量的氯化钙溶液、少量的硫酸铜溶液进行试验,依次观察到产生和,证明猜想三成立。小玉为什么用氯化钙溶液而不用澄清的石灰水呢?。
【拓展应用】“氧气再生剂”的保持方法是。
学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑。在老师的帮助下,用金属钠来探究下列问题:
【提出问题】1.金属钠能否置换出硫酸铜溶液中的铜?
2.金属钠能否在其他气体(如:CO2)中燃烧?
【查阅资料】金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应放出氢气。
【实验探究】
实验一:①在实验室中,金属钠保存在煤油中;
②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红。
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
(1)金属钠保存在煤油中的原因是:。
(2)根据上述资料写出钠块投入水中发生反应的化学方程式:。钠投入硫酸铜溶液中总的化学反应方程式。氢氧化铜受热分解成氧化铜和水,若将24.0g剩余固体继续高温加热,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式。
(3)实验二中生成的黑色颗粒是,而白色物质可能是什么呢?
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是氧化钠,乙认为是碳酸钠,丙认为是氧化钠和碳酸钠的混合物,丁认为是氢氧化钠。
我认为丁的猜想是错误的,理由是。
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管里,滴加足量盐酸,溶液中有气泡冒出,结论:白色物质中一定有。
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液,填序号),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现。则(在甲、乙、丙中选)的猜想成立。
③评价与反思:小娟同学认为实验方案1得出的结论不正确,其理由是;
实验室中的金属钠着火时,你的灭火方法是。
【拓展应用】测定实验中使用的标有质量分数为16%的盐酸(图1)的实际质量分数。
(1)为了测定,需配制20%的氢氧化钠溶液100g。配制步骤有:①溶解 ②计算,需氢氧化钠g ③装瓶并贴标签 ④称取氢氧化钠,量取水mL(水的密度为1g/mL)。其正确的顺序为(填序号)。
配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及。
(2)小明同学在烧杯中加入配得的氢氧化钠溶液20g,再逐滴加入该盐酸。用pH测定仪测定滴加过程中溶液的pH。图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图。
①a点对应的溶液呈(填“酸性”、“碱性”或“中性”);b点对应的溶液中的溶质为(写化学式)。
②请以此次测定的数据,列式计算该盐酸的实际质量分数?
(3)该盐酸的实际质量分数与标签上标出的质量分数不一致的可能原因(不考虑误差)。
下图为实验室常用的实验装置,请回答问题: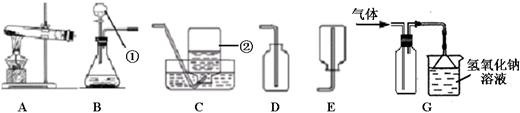
(1)写出带有标号仪器的名称:①;②。
(2)若用A、C装置组合制取O2,当看到水槽中气泡时,开始收集。收集完毕时,应先。
(3)写出用B、E装置组合制取某气体的化学反应方程式。
(4)H2S是有毒气体,溶于水成氢硫酸。实验室常用块状硫化亚铁(FeS)和稀H2SO4常温发生复分解反应制H2S。某同学用G装置来收集处理H2S。
①实验室制H2S的化学方程式为。
②用G装置来收集处理H2S,说明其密度比空气。
③G装置中氢氧化钠溶液的作用是,漏斗的作用是。