如图为NaCl、KNO3的溶解度曲线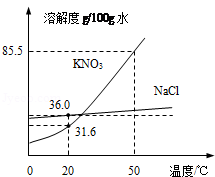
① 20℃时,KNO3的溶解度是 g/100g水。
② 两种物质溶解度的变化受温度影响较小的是 。
③ 20℃时,将40gNaCl固体 投入到100g水中,得到的NaCl是 (填“饱和”或“不饱和”) 溶液,此时溶液中溶质质量分数是 (保留到0.1%)。
④ 除去KNO3固体中混有的少量NaCl,提纯的步骤是:
加水溶解、蒸发浓缩、 ,然后过滤、洗涤、干燥。
⑤ 把KNO3不饱和溶液变为饱和溶液,下列有关说法正确的是 (填序号,)
| A.溶剂的质量一定变小 | B.溶质的质量可能不变[ |
| C.溶质的质量分数一定变大 | D.该饱和溶液还可以溶解其它物质 |
化学与生产、生活有着密切联系.
(1)玻璃的主要成分是二氧化硅,盛装
的试剂瓶瓶塞是橡胶塞.如果是玻璃塞,则会与NaOH反应而使瓶颈与瓶塞粘连无法打开,请用化学反应方程式表示其原理.
(2)中秋节是中华民族的传统节日,天南地北的华人都有赏月吃朋饼的习俗.而在制月饼时会在面粉中加入发酵粉:小苏打,在焙制月饼时需高温加热.而小苏打热稳定性差,试写出其受热分解的化学方程式,
(3)建设社会主义新农村的任务之一是改变农村的燃料,改善农村生活环境,提高生活质量、国家鼓励和支持建造沼气池.请写出沼气燃烧的化学方程式,
(4)已知某物质的化学式为
.试写出R硫酸盐的化学式,
在宏观﹣微观﹣化学符号三者之间建立联系是化学学科特有的思维方式.现有下列微观结构示意图,请按题意要求用离子符号若化学式填空: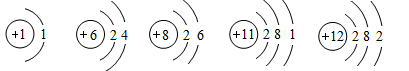
(1)写出图中表示离子的符号;
(2)妈妈手上的钻戒;
(3)碳酸饮料中的酸;
(4)一种医疗上用于消毒的液体;
(5)一种用于军事上制造照明弹、闪光弹的金属.
下列是实验室制取气体和收集气体的实验装置,根据装置图回答问题。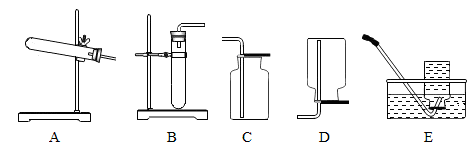
(1)实验室用氯酸钾与二氧化锰制取氧气,发生装置应选择(填编号),装置中还缺少的玻璃仪器是.
(2)实验室用过氧化氢溶液与二氧化锰制取氧气,其化学反应方程式是,为了便于观察氧气是否集满,应选用的收集装置是(填编号)
常温下,氯气(
)是一种黄绿色由刺激性气味比空气重的有毒气体,常用于自来水消毒,原因是氯气能与水反应生成次氯酸(
)和氯化酸,其中次氯酸能杀菌消毒,次氯酸不稳定,见光易分解成氯化氢和一种单质气体.根据以上信息回答下列问题:
(1)氯气的物理性质是(只写2点)
(2)写出次氯酸中氯元素的化合价
(3)写出氯气与水反应的化学反应方程式
(4)写出次氯酸分解的化学反应方程式.
5.1假期,小明和父母到华蓥山革命老区参观游览,感受大自然的美,接受革命传统教育,请你用学过的化学知识解决他们在游览中遇到的问题。
(1)他们进入景区大门,场地上各种鲜花盛开,香气扑鼻,用分子观点解释闻到花香的原因,他们看到员工正在给花草施用化肥硝酸钾,小明给父母解释施用的化肥中含有营养元素是(填元素符号)
(2)他们在山顶进行了简单的午餐,下面的食品主要补充维生素的是
| A. |
面包 |
B. |
香肠 |
C. |
苹果 |
D. |
高钙牛奶 |
(3)返回下山途中,小明拾取了一些不文明游客乱扔的物品,其中属于金属材料的是
| A. |
矿泉水瓶 |
B. |
易拉罐 |
C. |
塑料袋 |
D. |
门票及导游图 |
(4)小明用空瓶装了一瓶山泉水带回实验室,与同学们分享.检验山泉水是硬水还是软水,可选择的物质是
| A. |
氧化钠 |
B. |
盐酸 |
C. |
肥皂水 |
D. |
明矾 |
(5)对该山泉水进行净化提纯,其净化程度最高的方法是
| A. |
过滤 |
B. |
蒸馏 |
C. |
沉淀 |
D. |
吸附 |