碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的、以化合态形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是____________________________。
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。 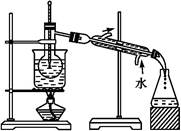
“低钠盐”可以控制钠的摄入量从而防治高血压等疾病.制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl.国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2).
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%.该样品a的水溶液中,含量最多的离子是 (填离子符号).
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种).请设计实验方案,完成下列表格.
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水
| 实验操作 |
预期现象及结论 |
| 步骤1:取少量样品b于烧杯中, |
样品溶解,形成无色溶液. |
| 步骤1:取少量步骤1形成的溶液于试管中,在滴加少量NaOH溶液,振荡 |
,说明样品b中添加了镁盐 |
| 步骤3: |
|
实验室常用下列装置制取气体,请你根据所学知识回答下列问题。
(1)仪器a的名称是 。
(2)实验室制取氧气时,选用的收集装置是 (填字母序号)。
若改用下图装置收集氧气,则气体应从 进(填“a”或“b”)。
(3)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为______________________________;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体。
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色。于是排除了猜想A,你认为排除猜想A的理由是_____________。
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验。请你帮他完成实验,填写以下表格:
| 实验步骤 |
实验现象 |
实验结论 |
| 气体中有HCl |
【查阅资料】
碳酸钠溶液中通入二氧化碳发生反应: Na2CO3 + CO2 + H2O = 2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为 (填字母)。
工业烟气通常含有二氧化硫,在排放前需经脱硫处理。右下图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略)。
请回答下列问题:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅱ所属的基本反应类型是 ,CaSO3中Ca、S、O元素的质量比是 。
(3)已知原料NaOH的价格为2.9元/kg、Ca(OH)2的价格为0.36元/kg。两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是 。
配制并稀释一定质量分数的Na2SO4溶液.
(1)配制50g质量分数为6%的Na2SO4溶液.
①计算:需要Na2SO4 3.0g,水 47.0g
②称量:用托盘天平称量3.0g的Na2SO4.天平调零后,分别在天平左右托盘放上质量相同的纸片,先 ,然后 ,至托盘天平恰好平衡.
③量取:用量筒量取47.0mL水.请在如图中画出47.0mL水的液面位置.
④溶解.
(2)稀释溶液.(由于整个配制过程中溶液很稀,其密度可近似看做1g/mL)
①取1mL 6%的Na2SO4溶液加水稀释至100mL,得到溶液a;
②若用3.0gNa2SO4配制与溶液a浓度相同的溶液,其体积是 mL.
空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。下图是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
(1)步骤①中发生的是________变化(填“物理”或“化学”)。
(2)写出步骤③中发生反应的化学方程式_________________________________。
(3)上述化学反应中属于化合反应的有________个。
(4)下图是化肥硝酸铵包装袋上的部分说明:硝酸铵应具有的性质是 (填字母)。
A.易溶于水B.有挥发性C.受热易分解
施用该类肥料时,要避免与碱性物质混合使用,写出硝酸铵与熟石灰反应的化学方程式__________________________________。