工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+ O2(g) →
O2(g) →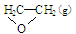 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为 kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是 。
(6分)实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。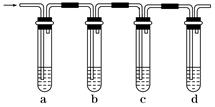
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(2)确定含有乙烯的现象是_________________________________________________。
给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极的反应式为_______。b电极的反应式为_________。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是 _________________
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为;它含有的化学键类型有(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正负极电极反应式为_________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
指出下列反应的反应类型。
(1) CH2===CH2+Br2―→CH2BrCH2Br,反应类型:__________。
(2) CH3CH3+2Cl2 CH2ClCH2Cl+2HCl反应类型:________。
CH2ClCH2Cl+2HCl反应类型:________。
(3)C2H4+3O2 2CO2+2H2O,反应类型:___________。
2CO2+2H2O,反应类型:___________。
(7分)用下列:①H2O②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空。(填序号)
(1) 由离子键和非极性键构成的是 (2) 由极性键和非极性键构成的是
(3) 不存在化学键的是(4) 共价化合物有
(5) 含有极性共价键的离子化合物的是