根据下面物质间转化的框图,回答有关问题;
`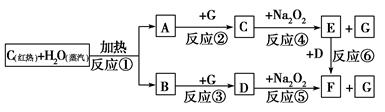
(1)由反应①产生的A、B混合物的工业名称是________。
(2)写出框图中D、E的化学式:D________;E________。
(3)如果2 mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是________L,同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(4)如果A、B混合气体7.8 g,在与G充分反应后,通过足量Na2O2层,可使Na2O2增重________g。
化学电池在通讯、交通及日常生活中有着广泛的应用。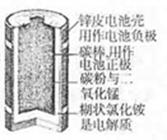
(1)右图是锌锰干电池的基本构造图,关于该电池的使用和性能,说法 正确的是
正确的是
A.该 电池可充电后反复使用
电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为: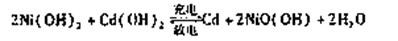
已知Ni(OH)2和Cd(OH)2均难于溶于但酸,以下说法正确的是 A.以上反应是可逆反应 B.反应环境为碱性
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd做负极 D.是一种二次电池
(3)美国阿波罗的氢氧燃料电池是一种新型电源,其构造如图所示,a、b两个电极均由多孔的碳块组成,通入氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。
①其电极为a是极(填正或负)
②若为飞行员提供了360kg的水,则电路中通过了mol电子。
25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式:;此反应的平衡常数表达式K=,从反应开始到达第一次平衡时的平均速率v(A)为。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
 |
 |
 |
 |
 |
 |
 |
 |
K1、K2、K3、K4之间的关系为:(用“>”、“<”或“=”连接)A的转化率最大的一段时间是
已知A是乙烯,B、C、D、E均为常见的有机物,在一定条件下,它们有如下力
所示的转化关系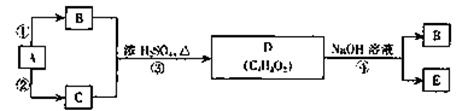
请回答:
(1)C的结构简式是
(2)能与金属钠反应放出氢气的物质有(填字母)
(3)在图示转化关系中,属于加成反应的有(填序号)
(4)A、B、C三种物质的摩尔质量由大到小的顺序是
(5)反应④的化学方程式是
元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第族。根据元素周期律、预测;酸性强弱H2AsO4H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为,在一定 条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度。(选填“更大”、“更小”或“相同”)
条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
工业上生产硫酸 时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%
时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% ,O2 11%,N2 82%);
,O2 11%,N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)利用 表中数据推断SO2的氧化是(填“吸热”或“放热”)反应;
表中数据推断SO2的氧化是(填“吸热”或“放热”)反应;
(2)在400~500℃时,SO2的催化氧化采用(填“常压”或“高压”);
(3)选择适宜的催化剂,是否可以提高SO2的转化率?(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。