在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
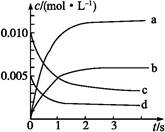
(1)上图表示NO2的浓度变化的曲线是 。用O2表示从0~2 s内该反应的平衡速率v= 。
(2)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: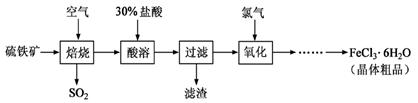
回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。
下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
| 元素名称 |
钪 |
钛 |
钒 |
铬 |
锰 |
| 元素符号 |
Sc |
Ti |
V |
Cr |
Mn |
| 核电荷数 |
21 |
22 |
23 |
24 |
25 |
| 最高正价 |
+3 |
+4 |
+5 |
+6 |
+7 |
(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________ Ti_______________________________
V ____________________________ Mn ______________________________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是:___________________________________________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是__________________________________________________________;出现这一现象的原因是_________________________________________。
按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):
;
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):
、;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B—的离子,通常所用的试是_________和_______。
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法是______________________。
写出下列元素基态原子的电子排布式:
(1) N (2)Ne
(3)S(4)Ca
(5)29Cu(6)32Ge
A、B、C、D、E、F六种短周期元素,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道数有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且离子半径A小于F。回答:
(1)上述六种元素中,哪种元素的原子的第一电离能最大?说明理由。
(2)比较C、D元素的第一电离能,并解释。
(3)将上述六种元素按电负性从小到大排列。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物还是共价化合物?