溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
② ;
③ 。
(2)实验②平衡时B的转化率为 ;实验③平衡时C的浓度为 。
(3)该反应的ΔH 0,其判断理由是 。
(4)该反应进行到4.0 min时的平均反应速率:
实验②:v(B)= 。
实验③:v(C)= 。
现有①汽车②机器上的齿轮③门把手④锯条⑤铁洗脸盆等常见铁制品。为了防止它们生锈,通常适合采用下面哪一种方法。(填序号)
(1)在表面喷漆_________;(2)在表面涂油_________;(3)在表面镀一层其他金属_________;(4)在表面烧制搪瓷_________;(5)使其表面形成致密的氧化物保护膜_________;(6)制成不易生锈的合金不锈钢_________;
近年来,为满足某些尖端技术的发展需要,人们又设计和合成了许多新型合金材料。如:储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。此外, 、、和等新型合金广泛应用于卫星、航空航天、生物工程和电子工程等领域。
、、和等新型合金广泛应用于卫星、航空航天、生物工程和电子工程等领域。
人体缺碘会影响正常的生命活动。为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道,人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图: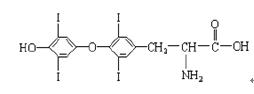
(1)加碘食盐中碘的存在形式主要是________;(2)甲状腺素的分 子式为___________。
子式为___________。
蛋白质分子结构的多样性,决定了蛋白质分子具有多种重要功能。如淀粉酶、胃蛋白酶在消化中的________功能,胰岛素可以对糖类物质的代谢具有________功能,免疫球蛋白在人体中的_________功能等。
(14分,每空2分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)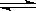 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为mol/(L·min)。
(2)若上述反应在 甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:①甲v(X)=3. 5mol/(L·min);②乙v(Y)=2mol/(L·min);
甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:①甲v(X)=3. 5mol/(L·min);②乙v(Y)=2mol/(L·min);
③丙v(Z)=4.5mol/(L·min);④丁v(X)=0. 075mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向(填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向(填" 左 " 或 " 右 " 或 " 不移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较。
| A.无法确定 | B.⑷一定大于⑴ |
| C.⑷一定等于⑴ | D.⑷一定小于⑴ |
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,则a、b 、c应该满足的
、c应该满足的 关系为
关系为
。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为。