把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) = CO2(g)
途径II:先制水煤气: C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g) = 2CO2(g);
2H2(g)+O2(g) =2H2O(g)
已知:①C(s)+O2(g)=CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 1/2O2 (g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)CO(g) + H2O(g) = H2(g) + CO2(g) 是 (填“放热反应”或“吸热反应”)
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H= 。
(3)根据两种途径,下列说法错误的是( )
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
工业合成有机物F路线如下: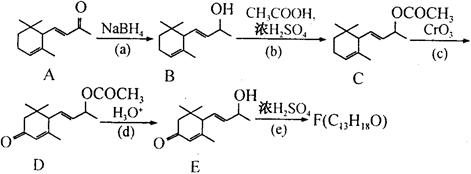
(1)有机物D中含氧的官能团名称为和。
(2)化合物F的结构简式是。
(3)在上述转化关系中,设计步骤(b)和(d)的目的是。
(4)写出步骤(d)的化学反应方程式。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式。
| A.属于芳香化合物 | B.核磁共振氢谱有四个峰 |
| C.1mol该物质最多可以消耗2molNaOH | D.能发生银镜反应 |
(6)已知: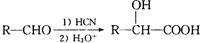 ,写出以乙醇和
,写出以乙醇和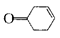 为原料制备
为原料制备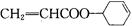 的合成路线图(无机试剂任选)。合成路线流程图示例如下:
的合成路线图(无机试剂任选)。合成路线流程图示例如下: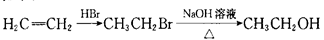
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下: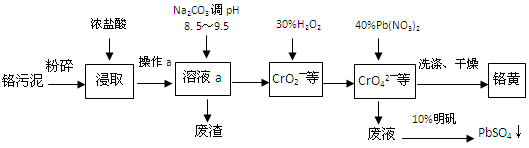
(1)将铬污泥粉碎的目的是。操作a的名称为。
(2)废渣的主要成分是Al(OH)3和Fe(OH)3。已知25℃时,Al(OH)3的Ksp=1.3×10—33,则该温度下反应Al3+ + 3H2O  Al(OH)3 +3H+的平衡常数为。
Al(OH)3 +3H+的平衡常数为。
(3)写出加入30%H2O2过程中发生的离子反应方程式:。
(4)加入Pb(NO3)2沉淀CrO42—时,检验沉淀是否完全的方法是。
(5)在废液中加入10%明矾溶液发生反应的化学方程式为。
下列物质含有少量杂质,请在空格中填上适宜的试剂将杂质除去,并写出相应的方程式(是离子反应的写离子方程式)。
| 物质 |
杂质 |
试剂 |
化学(离子)方程式 |
| ①CO2 |
HCl |
||
| ②Fe(OH)3 |
Al(OH)3 |
||
| ③Cu |
Mg |
下表是元素周期表的一部分,表中的数字表示一种短周期元素,回答下列问题: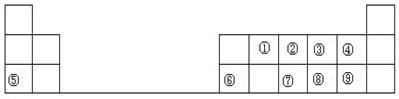
(1)画出②的原子结构示意图:。
(2)③、④、⑦、⑧四种元素所形成的气态氢化物中最稳定的是______(填化学式)。
(3)①在元素周期表中的位置是。
(4)⑧、⑨元素的最高价氧化物对应水化物的酸性比较:> ___ (填化学式)。
(5)写出⑤和⑨组成的化合物的电子式:。
(6)④、⑤、⑥的原子半径由大到小的顺序是:____>____>____(用元素符号表示)。
指出下列反应属于吸热反应还是放热反应。
①燃烧木炭取暖; ②煅烧石灰石制生石灰;
③Ba(OH)2·8H2O晶体与氯化铵晶体反应; ④铝与稀盐酸反应;
⑤食物因氧化而腐败;⑥生石灰与水作用制熟石灰;
⑦灼热的炭与二氧化碳反应;⑧酸碱中和反应。