乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是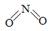 和
和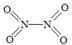 。
。
| 物质 |
NO2 |
N2O4 |
|
| 化学键 |
N=O |
N—N |
N=O |
| 键能(kJ/mol) |
466 |
167 |
438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。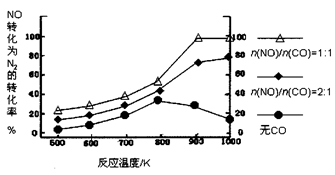
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 ;该反应的∆H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO发生反应的化学方程式为 。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g)ΔH=" +131.3" kJ/mol
CO(g)+H2(g)ΔH=" +131.3" kJ/mol
①以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
A.升高温度
B.增加碳的用量
C.加入催化剂
D.用CO吸收剂除去CO
②在体积不变的条件下,投入一定量的C(s)和H2O(g),下列能说明反应达到平衡状态的是_____________。
A.体系压强保持不变
B.体系的气体平均相对分子质量不变
C.CO和H2的体积比保持不变
D.H2O的反应速率与H2的反应速率相等
(2)在900℃时,将2mol CO(g)和1mol H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应达到平衡时H2的体积分数为20%,通过计算求出该反应的平衡常数以及CO的平衡转化率。(要求写出计算过程,计算结果保留两位有效数字)。
CO2(g)+H2(g),反应达到平衡时H2的体积分数为20%,通过计算求出该反应的平衡常数以及CO的平衡转化率。(要求写出计算过程,计算结果保留两位有效数字)。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g)ΔH=-92.4kJ/mol。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图1:
2NH3(g)ΔH=-92.4kJ/mol。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图1:
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 ,判断依据是 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(1)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出表示C2H2燃烧热的热化学方程式_________________________。
(2)已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5 kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H3=-285.8kJ/mol
计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)= CH3COOH(l) ΔH=____(写出计算结果)
(3)已知:
CH4(g)+ 2O2(g)= CO2 (g) + 2H2O (l)△H= -Q1 kJ/mol
2H2(g)+O2(g)= 2H2O(g)△H= -Q2 kJ/mol
2H2(g)+O2(g)= 2H2O(l)△H="-" Q3 kJ/mol
取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复至常温,放出的热量为 _________。
(4)请认真观察右图,然后回答问题。
①图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量。
②已知热化学方程式:H2(g)+1/2O2(g) ===H2O(g) △H= -241.8kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 。
雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g) 2NO(g)△H1="a" kJ•mol﹣1
2NO(g)△H1="a" kJ•mol﹣1
②2NO(g)+O2(g) 2NO2(g)△H2="b" kJ•mol﹣1
2NO2(g)△H2="b" kJ•mol﹣1
③CO(g)+1/2O2(g) CO2(g)△H3="c" kJ•mol﹣1
CO2(g)△H3="c" kJ•mol﹣1
④2CO(g)+2NO(g) N2(g)+2CO2(g)△H4
N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4 = kJ•mol﹣1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp= (用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是 (填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 。 (5)探究反应④中平衡时CO2的体积分数与反应物中的比值、温度的关系,得到如图2所示的曲线。
(5)探究反应④中平衡时CO2的体积分数与反应物中的比值、温度的关系,得到如图2所示的曲线。
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 。
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线。
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
酸牛奶是人们喜爱的一种营养饮料,酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖,酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:CH3CH(OH)COOH。工业上它可由乙烯来合成,方法如下:
CH2=CH2 A
A B
B CH3CHO
CH3CHO C
C CH3CH(OH)COOH
CH3CH(OH)COOH
(提示:(1)CH3Cl+NaOH CH3OH+NaCl,
CH3OH+NaCl, 的加成类似于
的加成类似于 的加成)
的加成)
(1)乳酸所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③乳酸在一定条件合成聚乳酸 。
(3)写出符合下列要求的乳酸的所有同分异构体的结构简式 。
a、属于酯类 b、含有﹣OH c、能发生银镜反应.