某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是 (写2点)。
(2)固体混合物A中的成分是 。
(3)反应I完成后,铁元素的存在形式为 (填离子符号);写出生成该离子的离子方程式 。
(4)操作1主要包括: 、 、 。洗涤CuSO4•5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为 .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 。
某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、
HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有;
(2)当生成AlO2-时,可存在的离子有。
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与
Al2(SO4)3的物质的量浓度之比为 ___________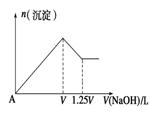
⑴在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂; 元素被氧化; ________是氧化产物;7mol HCl参与反应时转移的电子总数为_____mol.
⑵反应11P +15CuSO4 +24H2O = 5Cu3P + 6H3PO4 +15H2SO4中32g CuSO4能氧化磷的质量为_________g.
工业上为了除去铝材表面的自然氧化膜,常常将铝材浸入装有NaOH溶液的碱洗槽中。 碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3b.CO2 c. NaOH d.HNO3
由地壳中含量最高的金属元素和非金属组成的化合物的名称是________,铁红常用于制造红色油漆和涂料,它的化学式是____________.