某化合物M(式量为80)俗称黑肥宝,它由原子序数不大于20的X、Y、Z三种元素组成,X、Y、Z的原子序数依次增大,其关系为Z=X+2Y。X、Y是同周期相邻的两种元素。M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,A在高温条件下可分解产生一种有温室效应的气体。(注:以下回答若涉及到具体物质均用相应的化学式或元素符号表示)
(1)化合物M的化学式为 ;Z的原子结构示意图为 。
(2)写出下列反应的化学方程式。A在高温下分解: ; M与水反应生成A和B: 。
(3)Z的氢化物可作为一种储氢材料,写出其与水反应的化学方程式 。
(4)储氢材料的研究很广泛。下列物质中,可作为储氢材料的是 。(填编号)
| A.Ca(OH)2 | B.MgH2 | C.O2 | D.LaNi5 |
(5)物质B有如下转化关系: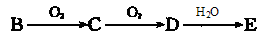 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(6分)将质量比为15∶7的NO和N2混合,则混合气体中NO和N2的物质的量之比为 ;氧原子和氮原子的个数之比为 ; 22 g该混合气体在标准状况下的体积为 L。
(9分)某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.4mol/L。现将一定量的铁粉投入到该溶液中,回答下列问题:
(1) CuCl2的电离方程式为 , 铁粉投入后反应的离子方程式为。
(2)原溶液中Cu2+的浓度为 mol/L。
(3)反应后测得Cl-的浓度为 mol/L。
(4)若反应后测得Fe2+的溶液为0.1mol/L,则反应生成铜单质的质量为 g。剩余的Cu2+的浓度为 mol/L。
(8分)稀HNO3和锌反应的化学方程式如下:
4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O
(1)请标明上述化学方程式中电子转移的方向和数目。
(2)该反应中还原剂是 ,还原产物是 ,每2 mol Zn参加反应,转移的电子 个。
(3)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
(4分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________mol/L。
(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。