根据下图所示化合物的结构,分析回答下列问题。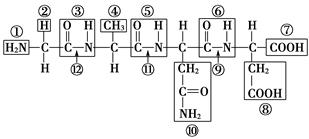
(1)该化合物中,①表示________,②表示________。
(2)该化合物由________个氨基酸失去________个水分子而形成。
(3)该化合物称为________,含________个肽键,编号是________________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。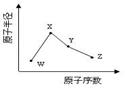
(1)X位于元素周期表中的位置;18W与X形成原子个数1:1的物质,该物质与H2O反应的化学方程式。(在化学式中标出质量数18)
(2)X的单质和Y的单质相比,熔点较高的是_____(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是_______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________。
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应⑤的离子方程式:________________________。
(4)请根据图中数据分析,原固体混合物的成分为(写化学式)
次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
①Ni2+ + H2PO2-+ → Ni+H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是,被还原元素是。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。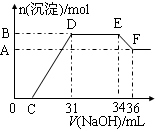
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式:,EF段生成含氧元素离子的名称是。
(2)合金中铁的质量为g 。
(3)C的值为mL。
(4)硝酸溶液的物质的量浓度为mol·L-1
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为: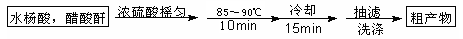
一、制备
二、提纯
方案1
方案2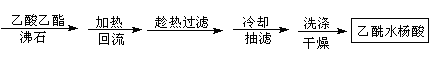
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(0C) |
水 |
醇 |
醚 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
易溶 |
易溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
可溶 |
易溶 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
可溶 |
微溶 |
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为溶液。
②本方案抽滤后进行洗涤,其具体操作是。
(2)方案2为改进的提纯方法,称为重结晶提纯法。
①步骤2回流的装置如图所示,写出仪器a的名称,使用温度计的目的是,冷凝水的流向为。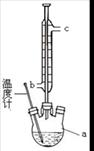
②方案2所得产品的有机杂质要比方案1少的原因是。
(3)该学习小组在实验中原料用量:2.0g水杨酸、5.0ml醋酸酐(ρ=1.08g·cm-3),最终称量产品m="2.2g" ,则乙酰水杨酸的产率为。