某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
①出现白色沉淀 ②无明显现象 |
白色物质为Na2CO3 |
回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式: 。
(2)甲同学认为方案1得到的结论不正确,其理由是 。
(3)乙同学认为方案2得到的结论正确,白色物质为 。
(4)钠在二氧化碳中燃烧的化学反应方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到 纯硝基苯。
纯硝基苯。
填写下列空白:
(1)配制一定比例浓H2SO4和浓HNO3混合酸时,操作注意事项是
。
(2)步骤③中,为了使反应在50℃~60℃下进行,常用的方法是。
(3)步骤④中洗涤、分离粗硝基苯使用的仪器是。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是。
(5)纯硝基苯是无色,密度比水(填“小”或“大”),具有气味的油状液体。
(6)实验室制备硝基苯化学方程式。
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_____
________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可先在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填试验操作名称)即可除去。
某兴趣小组同学进行乙醛的银镜反应,实验操作步骤如下:
| A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。 | B.在洗净的试管里配制银氨溶液。 | C.沿试管壁加入乙醛稀溶液。 |
| D.加热。请回答下列问题: |
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是:
。
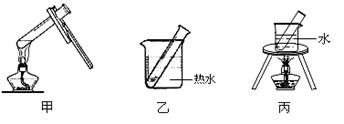
(2)步骤D应选择的加热方法是(填下列装置编号),理由是
。
(3)乙醛发生银镜反应的化学方程式为:
。
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):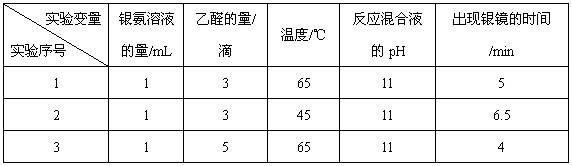
①实验1和实验2,探究的是。
②当银氨溶液的量为1 mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为min。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的。
(5)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中(含过量的银氨溶液,假设不含银)回收银的实验流程如下:
已知:[Ag(NH3)2]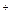 在溶液中存在平衡:[Ag(NH3)2]
在溶液中存在平衡:[Ag(NH3)2]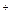
 Ag
Ag +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式。
②加入的铁粉要过量的目的是:。
某市进行学业水平考试实验操作考查,试题分别为:
Ⅰ.试验维生素C的化学性质(主要是还原性)。
Ⅱ.葡萄糖与新制氢氧化铜的反应。
Ⅲ.配制一定物质的量浓度的氯化钠溶液。
⑴试题中设置了“评价与反思”,下列“评价与反思”不合理的是:。(填序号)
| A.应该由监考老师去评价与反思 |
| B.实验结论告诉我:维生素C丸子应该密封保存 |
| C.维生素C能使淀粉的碘溶液褪色 |
| D.配制新制氢氧化铜时要将氢氧化钠与硫酸铜溶液等物质的量混合 |
E.实验Ⅲ中玻璃棒的作用是搅拌和引流
F.实验Ⅱ中的废水应该回收后再集中处理,不能直接倒入下水道
⑵实验Ⅲ中合理的实验操作顺序是:④。(填序号)
①溶解,②计算和称量,③转移和洗涤,④查漏,⑤定容和摇匀。
⑶实验Ⅱ考查结束后,发现试管内壁附着一层红色固体。为了洗干净试管,某学习小组尝试往试管中加适量(3mL)稀硝酸,发现红色固体立即消失,溶液呈蓝色,则该反应的离子方程式为: 。
(12分)实验室用加热l-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷,已知相关有机物的性质如下:
| 熔点/oC |
沸点/oC |
|
| 1-丁醇 |
—89.53 |
—117.25 |
| 1-溴丁烷 |
—112.4 |
—101.6 |
| 丁醚 |
—95.3 |
—142.4 |
| 1-丁烯 |
—185.3 |
—6.5 |
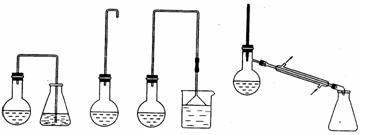
A B C D
⑴制备1-溴丁烷的装置应选用上图中的_______(填序号)。反应加热时的温度不宜超过
100℃,理由是_________________________。
⑵制备操作中,加入的浓硫酸必需进行稀释,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂。
⑶反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是______。该操作应控制的温度(t)范围是_______________。
⑷欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl