[双选题]700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
下列有关肥皂的叙述中错误的是()
| A. |
肥皂与纯碱的去污原理相同 |
| B. |
肥皂可以加速油污在水中的分散 |
| C. |
肥皂是油脂在碱性条件下水解生成的 |
| D. |
肥皂主要成分的分子中含有亲油基团和亲水基团 |
在5
0.05
的某金属氯化物溶液中,滴加0.1
溶液,生成沉淀质量与加入
溶液体积关系如图所示,则该氯化物中金属元素的化合价为:()


| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA |
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 |
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA |
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
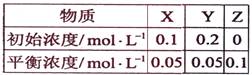
 下列说法错误的是:
下列说法错误的是:



A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
D.改变温度可以改变此反应的平衡常数 |
已知:
ΔΗ=234.1kJ·mol-1
ΔΗ=-393.5 kJ·mol-1
则
的ΔΗ是()
| A. | -824.4 kJ·mol -1 | B. | -627.6 kJ·mol -1 |
| C. | -744.7 kJ·mol -1 | D. | -169.4 kJ·mol -1 |