50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。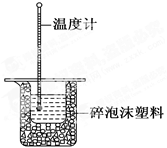
(2)烧杯间填满碎泡沫塑料的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大” “偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热数值会 (填“偏大”“偏小”或“无影响”)
[化学选修──有机化学基础]
根据图示回答下列问题:
(1)写出A、E、G的结构简式:A_____________,E_______________,G______________;
(2)反应②的化学方程式(包括反应条件)是_________________________,
(3)反应④化学方程式(包括反应条件)是______________________ ______________;
(4)写出①、⑤的反应类型:①________________、⑤__________________。
为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y中SO2的体积分数为____。(相对原子质量:O—16 S—32 Ba—137)
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式____。
(3)装置A中试剂的作用是____。
(4)简述确认气体Y中含有CO2的实验现象。
(5)如果气体Y中含有H2,预计实验现象应是。
下图中A~J均代表无机物或其水溶液,其中A是一种红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
根据图示回答问题:
(1)写出下列物质的化学式:A ,E,I;
(2)反应①的化学方程式是;
反应②的化学方程式是;
(3)J与盐酸反应的离子方程式是;
反应后的溶液与D反应的化学方程式是。
(1)在“探究求合力的方法”的实验中,要求每次合力与分力产生相同的效果,必须:( )
A.每次将橡皮条拉到同样的位置 B.每次把橡皮条拉直
C.每次准确读出弹簧秤的示数 D. 每次记准细绳方向
(2)某实验小组在“探究加速度与物体受力的关系”实验中,设计出如下的实验方案,其实验装置如图所示。已知小车质量 ,砝码盘质量
,砝码盘质量 ,所使用的打点计时器交流电频率
,所使用的打点计时器交流电频率 Hz。其实验步骤是:
Hz。其实验步骤是: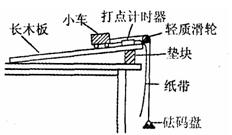
A.按图中所示安装好实验装置;
B.调节长木板的倾角,轻推小车后,
使小车能沿长木板向下做匀速运动;
C.取下细绳和砝码盘,记下砝码盘中砝码的质量 ;
;
D.先接通电源,再放开小车,打出一条纸带,由纸带求得小车的加速度 ;
;
E.重新挂上细绳和砝码盘,改变砝码盘中砝码质量,重复 步骤,求得小车在不同合外力
步骤,求得小车在不同合外力 作用下的加速度。
作用下的加速度。
回答以下问题:
①按上述方案做实验,是否要求砝码和砝码盘的总质量远小于小车的质量? (填“是”或“否”)。
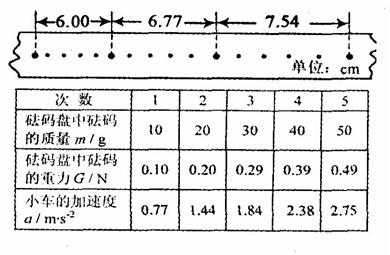
②实验中打出的一条纸带如图所示,由该纸带可求得小车的加速度
 。
。
③某同学将有关数据填入他所设计的表格中,并根据表中的数据画出 图象(如图)。造成图线不过坐标原点的一条最主要原因是 ,从该图线延长线与横轴的交点可求出的物理量是 ,其大小是 。
图象(如图)。造成图线不过坐标原点的一条最主要原因是 ,从该图线延长线与横轴的交点可求出的物理量是 ,其大小是 。
按以下装置图进行实验,填写有关现象及化学方程式
①简述如何检验此装置的气密性
。
②B中浓硫酸的作用是____________________
③C中发生反应的化学方程式为
④D中现象是____________________,
反应的离子方程式是
⑤E中收集的气体是____________________