某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
(2)①的X可选用(填化学式),其目的是 。加入氨水要过量的原因是 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是 (列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果 (“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示 。
。
对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
Ⅰ.(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是。
A、溶解后的溶液未冷至室温就转入容量瓶中;
B、洗涤烧杯和玻棒的溶液未转入容量瓶中;
C、定容时眼睛俯视刻度线;
D、定容时眼睛仰视刻度线;
Ⅱ.(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
 ①写出甲中发生反应的离子方程式:
①写出甲中发生反应的离子方程式:
②乙中盛的试剂是;作用是。
丙中盛的试剂是。
(2)如果将过量二氧化锰与20 mL该浓盐酸混合加热,充分反应后理论上可生成标况下的氯气的体积
为mL,而实际值明显少于理论值,其主要原因有:
①;②。
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变色,其离子方程式是,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显色,这种操作叫做。
(4)若将制得的氯气制成饱和氯水,则实验室保存饱和氯水的方法是。
(5)用滴管将新制饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,褪色的原因可能有两种(用简要文字说明)①是由于;②是由于。简述怎样用实验证明红色褪去的原因是①或者②。
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 |
D.反应开始不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
实验② ,
实验③ ;
(2)实验结论: 。
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 |
实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是___________________,改进的办法是____________。
已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
| 实验 1 |
实验步骤 |
实验现象 |
| ⅰ.取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 |
ⅰ.溶液呈棕黄色。 |
|
| ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 |
ⅱ.溶液不显红色。 |
①写出FeCl3溶液与KI溶液反应的离子方程式。
②加入KSCN溶液的目的是。
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
| 实验 2 |
实验步骤 |
实验现象 |
| ⅰ.取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 |
ⅰ.溶液呈棕黄色。 |
|
| ⅱ.向其中滴加2滴0.1 mol·L-1 KSCN溶液。 |
ⅱ.溶液显红色。 |
|
| ⅲ.继续加入2 mL CCl4,充分振荡、静置。 |
ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是。用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因:。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
①为验证假设,乙同学设计并完成了实验3。
| 实验3 |
实验步骤 |
实验现象 |
| ⅰ.取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 |
ⅰ.液体分层,上层呈黄色,下层呈紫红色。 |
|
| ⅱ.取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 |
ⅱ.液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是。
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中。
两支试管中的现象分别为。
硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如下图所示: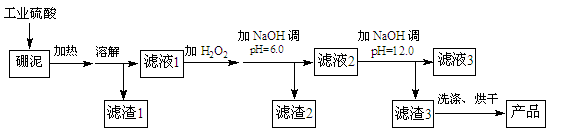
已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 Al(OH)3 |
2.7 3.7 |
3.7 4.7 |
(1)MgO的电子式为。
(2)滤渣2的主要成分是,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为。
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示)。