某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 |
D.反应开始不十分剧烈;产生无色气体。 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
|
|
|
|
|
|
实验② ,
实验③ ;
(2)实验结论: 。
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:
(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证 卤族元素性质的递变规律。图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
(2)甲同学设计的实验中所涉及反应的离子方程式分别为___________________________________________________;
________________________________________________________________________。
(3)乙同学的实验原理是______________________________________________。
写出B处的离子方程式: ___________________________________________________。
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中;
C.容量瓶内壁沾有水滴没有烘干就进行配制;
D.定容时俯视;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
某同学应用如下所示装置研究物质的性质。其中气体C的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: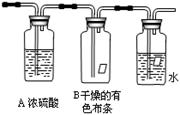
(1)该项研究的主要目的是探究氯气与水反应后生成的物质具有性。
(2)浓硫酸的作用是。
(3)观察到的实验现象是B中,C中。
(4)从物质性质方面来看,这样的实验设计还存在事故隐患,事故表现在。要克服该事故隐患,选择的操作是下图的,
并写出与解决隐患相关的离子方程式表示:。
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。