下列事实与结论(或推论)均正确的是
| A.将氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,说明所得溶液中c(Ag+)·c(Cl-)>Ksp(AgCl) |
| B.物质的量之比为1: 2的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3 |
| C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加NaOH溶液,立即产生红褐色沉淀;那么向FeI2溶液中通入少量的氯气,也会出现同样的现象 |
| D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2 |
已知25℃、101 kPa时,乙烯和乙炔(C2H2)燃烧的热化学方程式分别为 ΔH=一1411 kJ/mol
ΔH=一1411 kJ/mol ΔH=一2600 kI/mol
ΔH=一2600 kI/mol
又知燃烧时火焰的温度乙炔高于乙烯。据此,下列说法不正确的是 ( )
| A.物质的燃烧热越大,火焰温度越高 |
| B.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少 |
| C.25℃、101 kPa时,1 mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ |
| D.乙炔的燃烧热为1300 kJ/mol |
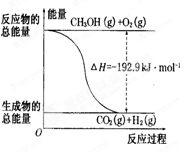
已知①CH3OH(g)+H20(g)=O2(g)+3H2(g)△H=+49.O kJ/mol
②CH3OH(g)+1/202(g)=CO2(g)+2H2(g)△H=-192.9 kJ/m01
下列说法正确的是 ()
| A.CH30H转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
| C.根据②推知反应:CH3OH(l)+1/202(g)=CO2(g)+2H2(g)△H>一192.9 kJ/mol |
| D.反应②的能量变化如图所示 |
水的电离平衡曲线如图所示,下列说法不正确的是 ( )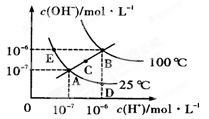
| A.图中五点KW间的关系B>C>A=D=E |
| B.若从A点到D点,可采用在水中加入少量酸的方法 |
| C.若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |
25℃时,5 mL O.1 m01/l的 H2S04和15 ml O.1 mol/LNa0H溶液相混合并稀释至500 ml,所得溶液的pH为 ( )
| A.12.3 | B.11 | C.3 | D.1.7 |
常温下,下列关系的表述中,正确的是 ( )
| A.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为l:l |
| B.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C.0.1 mol·L—NaHC03溶液中:c(Na+)>c(HCO3-)>c(CO32一)>c(H2C03) |
| D.浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;⑧CH3COONa溶液,溶液的PH②>③>① |