无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下

通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、 、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| |
观察到的部分现象 |
| 第一次实验 |
反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 |
反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 |
反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下: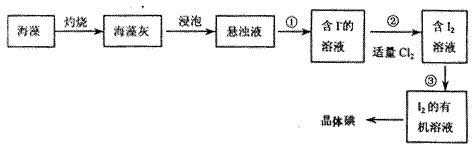
(1)指出提取的过程中有关实验操作名称:① ;③。
;③。
(2)提取碘的过程中,可供选择的有机溶剂是。
A. 水、酒精 B. 四氯化碳、苯 C. 汽油、酒精
(12分)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么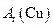 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算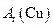 。为此,提供的实验仪器及试剂如下(根据需要
。为此,提供的实验仪器及试剂如下(根据需要 可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):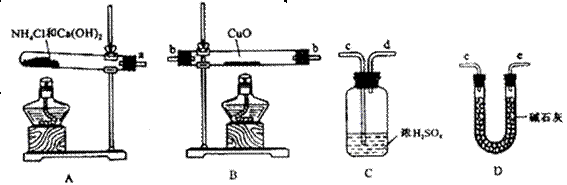
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=" a" g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
① CuO未完全起反应② CuO不干燥
③ CuO中混有不反应的杂质④碱石灰不干燥
⑤ NH4C1与Ca(OH)2混合物不干燥
NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或_______________和_______________达到实验目的。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定 管并使滴定管尖嘴充满液体
管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_______________ ___
___
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影 响”)___________________
响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)图19是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:mol/L
| 滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
氯化铁是常见的水处 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)试写出吸收塔中反应的离子方程式:。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是:。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250mL容量瓶,用蒸馏水定容;取出25mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL。
(已知:2Fe3+ +2I-= I2+2Fe2+I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:。
②滴定至终点,实验数据如下表所示: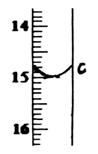
(第一次滴定终点的数据如右图中c点所示,请将你读得的数据填入表中)
| 滴定次数 |
待测液体积(mL) |
滴定前读数(mL) |
滴定后读数(mL) |
| 第一次 |
25.00 |
0.00 |
c= |
| 第二次 |
25.00 |
0.00 |
14.99 |
| 第三次 |
25.00 |
0.00 |
15.01 |
则样品中氯化铁的质量分数为(写出最终的计算结果)。
③下列操作可能使测定结果偏低的是。
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上 述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所
示的装置: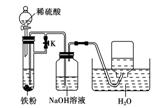
请简述实验操作及原理: