环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的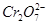 和
和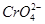 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为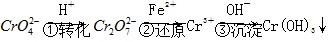 。
。
其中第①步存在平衡2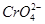 (黄色)+2H+
(黄色)+2H+
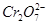 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 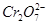 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含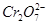 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。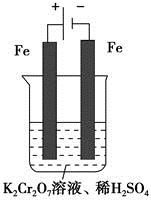
(10分)106gNa2CO3的物质的量为:,其中Na+的物质的量为:;C的微粒个数为:,O的质量为:;溶于水中配成溶液,与足量的盐酸反应放出的气体(标状状况下)体积为_____________(可用NA代表阿佛加德罗常数)
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取分液、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 _的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2) 在实验室中用自来水制取蒸馏水可用_________的方法.
(3)除去氧化钙中的碳酸钙可用的方法。
(10分)某同学现要对一份废液中所含的离子作出一些判定。已知溶液中可能是含有SO42-、Na+、CO32-、HCO3—、H+、NO3-、Cu2+、Cl—等离子中的若干种。经观察知:溶液无色、澄清。然后他又作了如下的分析:
①取少量溶液,用PH试纸 检验,得PH="1" 可知该溶液有强酸性
检验,得PH="1" 可知该溶液有强酸性
②重新取原溶液,用稀HCl 和BaCl2检验该溶液,有白色沉淀生成.
③将②所得的浊液静置,取上层清液,往清液中加入少量的AgNO3溶液和稀HNO3,结果又有白色沉淀生成
可得出结论:原溶液中一定有___________离子;
一定没有离子;可能有__________离子
写出步骤②的离子反应方程式:_____________________________
写出步骤③的离子反应方程式:_____________________________
(8分) (1)利用下列反应原理可以用于检查司机是否酒后开车。
2K2Cr2O7+3C2H5OH=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色)(酒精)(绿色)
①若司机酒后开车,检测器中的溶液显示出色
②在反应中,铬元素被___________(填“氧化”或“还原 ”)
”)
(2)一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
这句话指出维生素C在这一反应中做 _______剂,具有性。
(1)下列物质:①CO2②盐酸③烧碱晶体④酒精⑤铁⑥纯 醋酸(用编号回答)其中属于电解质的有;属非电解质的是。
醋酸(用编号回答)其中属于电解质的有;属非电解质的是。
(2)按要求写出下列反应的离子方程式:
①铁和盐酸反应:______________________________________
②CuSO4和Ba(OH)2反应: