已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
(2)该反应进行到45 s时达到平衡,此时CO2的转化率为68.75%。下图1中的曲线表示该反应在前25 s内的反应进程中CO2浓度变化。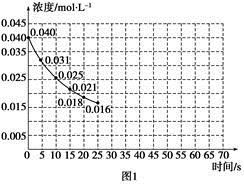
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
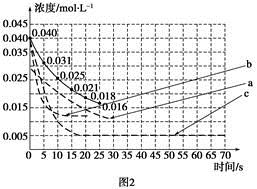
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
| 实验 编号 |
CO2起始 浓度/mol·L-1 |
反应温 度/℃ |
反应压 强/kPa |
是否加入 催化剂 |
| A |
0.030 |
150 |
101 |
否 |
| B |
0.040 |
150 |
101 |
否 |
| C |
0.040 |
250 |
101 |
是 |
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
阿斯匹林是常用的解热镇痛药物,通过下列流程可合成阿斯匹林和一种高分子化合物。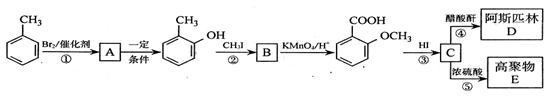

请回答下列问题:
(1)有机物A的结构简式为,④的化学反应类型是。
(2)在合成线路中,设计第②、③两步反应的目的是。
(3)阿斯匹林与足量NaO H溶液煮沸,发生反应的化学方程式是
H溶液煮沸,发生反应的化学方程式是
。
(4)反应⑤的化学方程式为。
(5) 的同分异构体较多。①其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为:
的同分异构体较多。①其中属于酯,并且苯环上的一氯代物只有两种的同分异构体的结构简式为: 、
、
;
②苯环上只有两个取代基且处于邻位的同分异构体可以形成比较稳定的环酯,写出一种环酯的结构简式:。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G极易溶于水且易液化.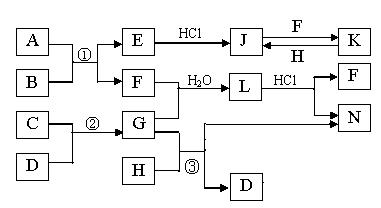
(1)化合物A中含有的短周期元素是(写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子 。
。
(3)写出③的化学方程式: 。
。
(4)若L为等物质的量F与G反应所得,L加入足量氢氧化钠溶液时反应的离子方程式为_______________
(5)已知C与D反应生成1.7g G 时放出4.62kJ的 热量,则该反应的热化学方程式为
热量,则该反应的热化学方程式为
。
硫酸工厂周围的空气中有较多的二氧化硫。某研究性学习小组为了测定空气(内含N2、O2、CO2、SO2等)中二氧化硫的体积分数设计了如下实验方案,下图是他们在测定中使用的部分装置图。
(1)在方框中画出所缺实验装置并标明所用试剂。(2)当装置中出现_________现象时,应立即停止通气体,若此时没有及时停止通气。则测得的SO2的体积分数(选填“偏高”、“偏低”或“不受影响” ,下同),若通入气体的速率过快,则测定的SO2的体积分数。
(3)你认为反应管内碘的淀粉溶液可以用下列 __(填代号)代替。
| A.氢氧化钠溶液 | B.高锰酸钾溶液 | C.品红 | D.淀粉碘化钾溶液 |
(4)研究小组经过讨论发现此方 案的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是。
案的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是。
(5)研究小组决定改用另一方案:取标准状态下的空气VL(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。则SO2的体积分数为。
在一定条件下可实现下图所示物质之间的变化,请填写以下空白:
已知:①孔雀石的主要成分是碱式碳酸铜 Cu2(OH)2CO3
② NaAlO2在酸性条件下可转化为 Al(OH)3
⑴明矾的化学式是。G的化学式是
⑵上图中物质F的电子式为。B电解的化学方程式
⑶沉淀H加热分解的化学方程式
明矾溶液与过量NaOH溶液反应的离子方程式为 。
⑷图中所得G和D都为固体,混合后在高温下可发生反应,该反应化学方程式为:
__________________________________________________________。
⑴棉花纤维的化学成分是。大豆油的主要成分是 。蚕丝和羊毛的化学成分是。如何区分棉纤维和羊毛?
⑵一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
1) 在人体中进行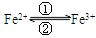 的转化时,①中的Fe2+作剂;②中的Fe3+作剂
的转化时,①中的Fe2+作剂;②中的Fe3+作剂
2) “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作剂,具有性;
3) 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为。
⑶汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为热能,最终转化为机械能;
2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式。