空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图如示。下列有关说法正确的是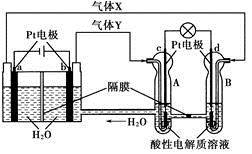
A.当有0.1 mol电子转移时,a电极产生2.24 L H2(标况)
B.b电极上发生的电极反应式为4H2O+4e-=2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-=2H2O
已知反应N2(g)+3H2(g)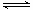 2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2NH3(g);ΔH<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是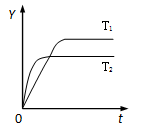
| A.N2的转化率 | B.混合气体的密度 |
| C.密闭容器的压强 | D.H2的体积分数 |
对于可逆反应N2(g)+3H2(g) 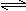 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g)  2NH3(g)△H=-92.4 kJ/mol。
2NH3(g)△H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③ > ① > ②
C.平衡时氨气的体积分数:① > ③ D.N2的转化率:② > ① > ③
可逆反应: 3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C不可能都是气体 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
| A.60 s内X的平均反应速率为0.0005 mol·L-1·s-1 |
| B.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大 |
| C.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |