一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |
| C.电池反应的化学方程式为CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应为O2+4e-+2H2O=4OH- |
某温度下,在容积固定不变的密闭容器中发生下列可逆反应:
2X(g) + Y(g) 2Z(g)△H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,放出热量Q kJ,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
2Z(g)△H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,放出热量Q kJ,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
| A.原平衡时,X的转化率为50% |
| B.达到新平衡时,X的转化率不变 |
| C.达到新平衡时,容器内气体的平均相对分子质量增大 |
| D.达到新平衡时,平衡常数K增大 |
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g)△H<0。有关该反应的说法正确的是
4NO(g)+ 6H2O(g)△H<0。有关该反应的说法正确的是
| A.反应达到平衡后,3ν正(NH3)=2ν逆(H2O) |
| B.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O) |
| C.其它条件不变,温度越高,氨的转化率越高 |
| D.增大压强是加快反应速率并提高NO产率的有效措施 |
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4的NH4Cl溶液,溶液中c(H+)>c(OH-),且c(H+)/c(OH-)=1×106 |
| C.AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
下列描述中正确的是()
| A.电解法制镁时一般是用熔融态的氯化镁进行电解,但也可用氯化镁溶液 |
| B.电解法生产铝时,可用钢网代替碳棒作阳极增大接触面积 |
| C.我国第五套人民币中的一元硬币材料为钢芯镀镍,在硬币制作时,钢芯应做阴极 |
| D.用电解法制备高纯度的镍,粗镍做阴极,精镍作阳极,阳极质量的减少与阴极质量的增加相等 |
已知铅蓄电池的总反应PbO2 +Pb +2H2SO4="=" 2PbSO4 + 2H2O ,图为铁铆钉铆在铜板上,有关叙述不正确的是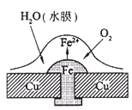
| A.铅蓄电池放电时,电路中每转移2mol电子,消耗1mol硫酸 |
| B.铅蓄电池充电时,阳极电极反应为PbSO4 + 2H2O- 2e- ="=" PbO2 + 4H+ + SO42- |
| C.铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
| D.如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 |