下列与金属腐蚀有关的说法,正确的是
| A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 |
| C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 |
| D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
某有机物的结构简式如图,该物质可能有的化学性质是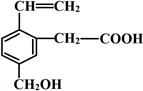
①可燃烧;
②可跟溴加成;
③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应;
⑤可跟NaOH溶液反应;
⑥1mol该有机物与足量Na反应生成1mol H2
| A.①②③⑥ | B.①②④⑤ | C.①②③④⑤ | D.全部 |
分子式为C4H10O且可与金属Na反应放出氢气的有机物有(不考虑立体异构)
| A.3种 | B.4种 | C.5种 | D.6种 |
乙醇中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是
| A.和金属钠反应时键①断裂 |
| B.在铜催化共热下与O2反应时断裂①和③ |
| C.在浓硫酸催化共热下与乙酸反应时断裂② |
| D.在空气中完全燃烧时断裂①②③④⑤ |
下列反应中前者属于取代反应,后者属于加成反应的是
| A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 |
| B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 |
| C.苯与浓硝酸和浓硫酸的混合液加热反应;乙烯与水在一定条件下生成乙醇的反应 |
| D.乙醇、乙酸和浓硫酸共热反应;乙醇在Cu的催化作用下和氧气反应 |
下列物质中互为同分异构体的是
A. C与 C与 C C |
| B.O2与O3 |
C.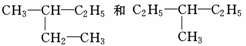 |
D. |