红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题: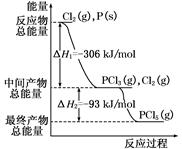
(1)P和Cl2反应生成PCl3的热化学方程式是 ;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50℃—60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,然后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是_______________。
(2)步骤③中,为了使反应在50℃—60℃下进行,常用的方法是_____________。
(3)步骤④中洗涤,分离粗硝是苯应使用的仪器是__________________________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是_______________________。
(5)纯硝基苯是无色,密度比水__________________(填“小”或“大”),具有________
气味的油状液体。
将三种气态烃以任意比例混合,与足量的氧气在密闭容器里完全燃烧,在温度不变的条件下( )其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?
)其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?
若已知某金属卡宾的结构示意为R---M=CH2(R表示有机基团、M表示金属原子),它与CH2=CHCH3的反应如下:
CH2=CHCH3 + R---M=CH2 R---M=CHCH3 + CH2=CH2
R---M=CHCH3 + CH2=CH2
CH2=CHCH3 + R---M=CHCH3 R---M=CH2 + CH3CH=CHCH3
R---M=CH2 + CH3CH=CHCH3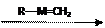 即 2CH2=CHCH3 CH2=CH2 + CH3CH=CHCH3
即 2CH2=CHCH3 CH2=CH2 + CH3CH=CHCH3
现有金属卡宾R---M=CHCH3和烯烃分子CH2=C(CH3)2它们在一起发生反应。请回答如下问题;
1.能否得到CH3CH2CH=CHCH2CH3(填“能”或“不能”)
2.产物中所有碳原子都在同一平面的的烯烃的结构简式是
3.生成的相对分子质量最小的烯烃的电子式为
4.若由CH2=C(CH3)2制CH2=CHCl则应选用的金属卡宾为
最近国外研究出一种高效的水果长期保鲜新技术:在3℃潮湿条件下的水果保鲜室中用一种特制的低压水银灯照射,引起光化学反应,使水果贮存过程中缓缓释放的催熟剂转化为没有催熟作用的有机物。试回答:
(1)可能较长期保鲜的主要原因是__________________________________________。
(2)写出主要反应的化学方程式___________________________________________。
下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上: (1)CH3—CH—CH2—CH3 2—乙基丁烷
(1)CH3—CH—CH2—CH3 2—乙基丁烷 CH2
CH2
CH3
 (2)CH3—CH—CH—CH3 3,4—二甲基戊烷
(2)CH3—CH—CH—CH3 3,4—二甲基戊烷 CH3 CH2
CH3 CH2
CH3
 CH3—CH2—CH2CH2—CH3
CH3—CH2—CH2CH2—CH3
 (3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷
(3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷 CH2 CH3
CH2 CH3
CH3