现有下列可逆反应:A(g)+B(g)  xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
请根据图像回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”);
(4)化学计量数x的值 (填取值范围);判断的依据是 。
处于下列状态的物质:
| A.氯化钠晶体 |
| B.CO2 |
| C.无水醋酸 |
| D.铁 |
E.BaSO4
F.熔融的氯化镁
G.酒精
H.氨水
(请用字母填写)。
(1)上述物质中能导电的是:______________
(2)上述物质中属于电解质的是:______________
(3)上述物质中属于非电解质的是:______________
(4)上述物质中属于强电解质的是:______________
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,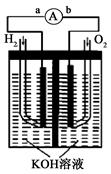 请回答:
请回答:
(1)氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为_______(用a、b表示)。
(2)负极反应式为。
(3)电极表面镀铂粉的原因是________________________。
现有25 ℃时0.1 mol/L的氨水,请回答以下问题:
(1)①若向该氨水中加入少量氯化铵固体,NH3·H2O的电离平衡_______(“向左”、“向右”或“不”)移动,此时溶液中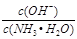 ________(填“增大”、“减小”或“不变”),在该过程中,水的离子积常数Kw(填“增大”、“减小”或“不变”);
________(填“增大”、“减小”或“不变”),在该过程中,水的离子积常数Kw(填“增大”、“减小”或“不变”);
②若向该氨水中加入稀盐酸,使其恰好完全中和, 所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式表示其原因,
所得溶液中各离子物质的量浓度由大到小的顺序为 。
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则溶液中[NH4+][Cl-](填“>”、“<”或“=”)
(2)已知某弱酸的难溶物CaA在水中存在溶解平衡:CaA(s)
 Ca2++A2- ΔH>0,
Ca2++A2- ΔH>0,
一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关。
①温度升高时,Ksp(填“增大”“减小”或“不变”,下同)。
②向浊液中通入HCl气体c(Ca2+)。
③测得25 ℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol·L-1,则溶液中c(A2-)=。
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH>0,
CH3OH(g)+H2O(g)ΔH>0,
经测得CO2和CH3OH(g)的浓度随时间变化如图所示。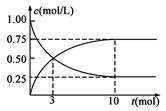
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=;
(2)该反应的平衡常数表达式K =;
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是(填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)
某氮肥厂氨氮废水中的氮元素多以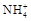 和NH3·H2O的形式存在,该废水的处理流程如下所示:
和NH3·H2O的形式存在,该废水的处理流程如下所示:
过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收a.n
过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下图: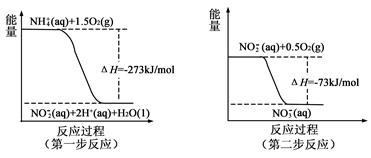
(1)第一步反应是_______________反应(选填“放热”或“吸热”),判断依据是__________。
(2)1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 。