O3可由臭氧发生器(原理如图)电解稀硫酸制得。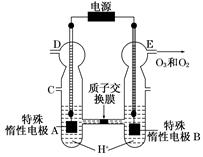
(1)图中阴极为 (填“A”或“B”),其电极反应式为 。
(2)若C处通入O2,则A极的电极反应式为 。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为 (忽略O3的分解)。
哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
| 分装日期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32- = 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。
中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式
是,
鉴别这两种气体不能选用的试剂是。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol/L的NaOH 溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的总化学方程式是,此时溶液中的离子按照浓度由大到小排列的顺序是。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一。C发生水解反应的离子方程式是。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阴离子的方法是
(简述操作过程及结论)。
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。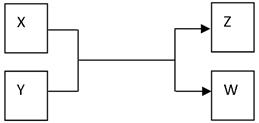
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
①,
原因是。
②,
原因是。
用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2气体。
(1)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是:。
(2)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2,N2保护下)制ClO2,其反应的化学方程式为:,
这一反应的优点是:。
(3)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
。
下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其
中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题: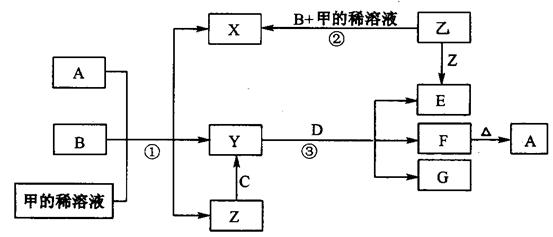
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为,C为(填写化学式)。
A与B物质的量应满足的关系为。
(2)写出反应③的化学方程式。
(3)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式,并分析产生气体的原因。