根据下列实验操作和现象所得出的结论错误的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
| B |
向某溶液中先滴加盐酸无现象,再滴加BaCl2溶液 |
有白色沉淀 生成 |
原溶液中含有SO42- |
| C |
分别测定同温同浓度NaCl与CH3COONa溶液的pH |
CH3COONa溶液的pH小 |
盐酸的酸性强于醋酸的酸性 |
| D |
向无水乙醇中加入浓H2SO4,加热至170°C将产生的气体通入酸性KMnO4溶液 |
紫红色褪去 |
使溶液褪色的不一定是 乙烯 |
下列大小比较正确的是
| A.离子半径:Na+>Mg2+>Al3+>Cl—;原子半径:Na>Mg>Al>Cl |
| B.稳定性:HF>H2O>NH3>CH4; 还原性: HF < H2O < NH3< CH4 |
| C.碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na |
| D.酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.羟基的电子式为: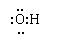 |
B.HClO的结构式:H—Cl—O |
C.丙烷分子的比例模型: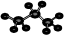 |
D.S2-的结构示意图: |
下列反应中,反应后固体物质增重的是
| A.乙醇蒸气通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与V2O5发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
下列说法不正确的是
| A.化学反应中一定有化学键断裂,同时也有化学键形成 |
| B.含有共价键的化合物必是共价化合物 |
| C.含有阴离子的化合物一定含有阳离子 |
| D.金属元素和非金属元素形成的化合物不一定是离子化合物 |
下列过程前者属于物理变化,后者属于化学变化的是
| A.碳酸钠晶体的风化、硫酸铜检验水 |
| B.煤的干馏、石油的裂化 |
| C.碘的升华、熔融的氯化镁导电 |
| D.煤的气化、用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |