镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。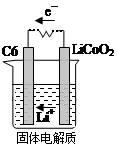
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下: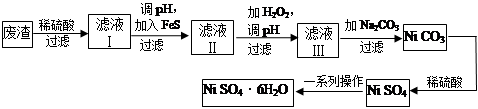
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=" +" 571.2 kJ・mol—1
BaS(s)= Ba(s)+S(s)△H=" +460" kJ・mol—1
已知:2C(s)+O2(g)=2CO(g)△H=" -221" kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)△H= 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。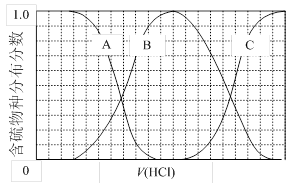
①含硫物种B表示。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为(填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是(用离子方程式表示)。
(4)硫的有机物(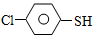 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中(填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中(填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:。
的核磁共振氢谱图。写出X的结构简式:。
WO3可用于制备电阻元件、电子射线屏等。其工业生产流程如下: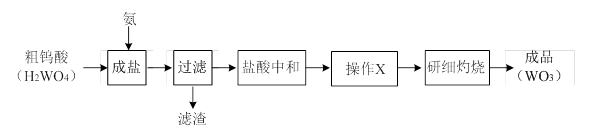
(1)操作X的目的是为了获得纯净的仲钨酸铵晶体,该操作包括:将用盐酸中和后的溶液、冷却结晶、、低温烘干。
(2)实际工业生产中,粗仲钨酸铵晶体(含少量NH4Cl晶体)可不经提纯就直接灼烧,其原因是。
(3)已知:仲钨酸铵晶体[x(NH4)2O·yWO3·zH2O]受热分解的化学方程式如下:
x(NH4)2O·yWO3·zH2O→WO3 +NH3↑+H2O↑(未配平)。
某同学为测定仲钨酸铵晶体的组成,进行如下实验:
①准确称取16.21g样品,研细灼烧;
②将产生的气体通入装有碱石灰干燥管,充分吸收称得干燥管增重1.44g;
③称量冷却后的固体质量为13.92g。
通过计算确定此仲钨酸铵晶体的化学式(写出计算过程)。
橙皮素具有抗氧化、消炎、降血脂、保护心血管和抗肿瘤等多种功效。它的合成路线如下: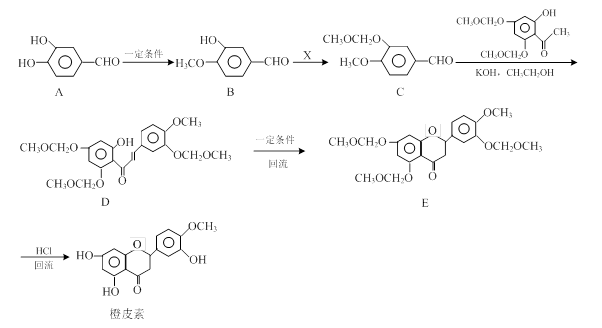
(1)化合物A中的含氧官能团有、(填官能团名称)。
(2)已知:B→C为取代反应,其另一产物为HCl,写出X 的结构简式:。
(3)反应D→E的反应类型是。
(4)写出同时满足下列条件的B的同分异构体的结构简式:。
Ⅰ.属于芳香族化合物;
Ⅱ.分子中有4种不同化学环境的氢;
Ⅲ.不能与FeCl3溶液发生显色反应,但能发生水解反应。
(5)已知:
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备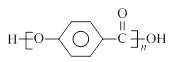 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: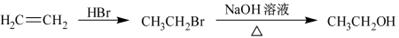
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: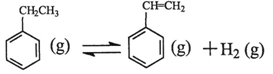 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g)△H2=+41.2kJ·mol-1
CO (g)+H2O (g)△H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应(填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是(填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度(填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为 ,则反应达到平衡时苯乙烯的浓度为,(均用含
,则反应达到平衡时苯乙烯的浓度为,(均用含 、P的表达式表示)。
、P的表达式表示)。
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式。
姜黄素(分子式为C21H20O6)具有搞突变和预防肿瘤的作用,其合成路线如下: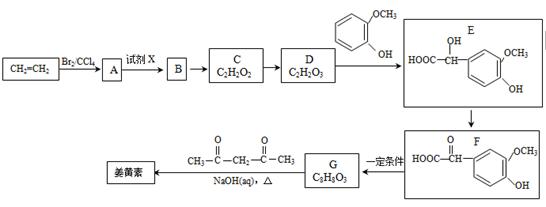
已知
①
②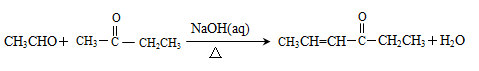
请回答下列问题:
(1)D中含有的官能团名称。
(2)试剂X为。
(3)姜黄素的结构为。
(4)反应D—E的化学方程式为,其反应类型是。
(5)下列有关G(C8H8O3)的叙述不正确的是(填正确答案编号)。
a.能与NaHCO3溶液反应
b.能与浓溴水反应
c.能与FeCl3溶液发生显色反应
d.1molG最多能与3molH2发生加成反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有种。
①苯环上的一取代物只有2种;
②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为。