苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理: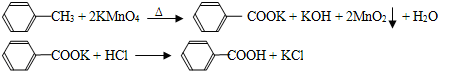
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。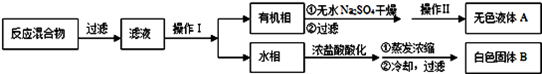
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体B加入水中, 加热溶解, |
得到白色晶体和无色溶液 |
|
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl- |
| ③ |
干燥白色晶体, |
|
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的氧化产物为______________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: ________________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为。(假设溶液体积不变)
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系: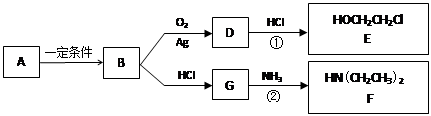
(1)B的电子式是。
(2)A可能属于下列哪类物质___________。
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): 化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)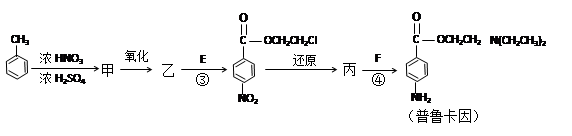
(甲苯)
(4)甲的结构简式是 _________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是:
(6)丙中官能团的名称是。
(7)已知RCOOR,+H2O→RCOOH+ R,OH叫做水解反应,普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
②D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是
在有机化合物中,由于基团之间的相互影响,会使有机物分子中相关原子或原子团的反应活性发生显著的变化。
①实验表明,丙酸CH3CH2COOH分子中“—CH2—”上的碳氢键因与“—COOH”相邻,
反应活性明显增强,比如,在红磷存在时,丙酸可与液溴反应生成2—溴丙酸
(CH3CHBrCOOH)。
②已知含有“—CCC—”结构的有机物不能稳定存在。请结合①②有关信息,分析如下转化关系,图中所用NaOH都是足量的,回答问题:
(1)A的结构简式为;图中A所发生的反应类型是; F中所含官能团的名称是。
(2)C→D的化学方程式为。
(3)D不可能发生的反应是(填字母代号)。
a. 水解反应 b. 消去反应 c. 中和反应 d. 酯化反应 e.氧化反应
(4)F有多种同分异构体,其中含有—C≡C—且属于甲羧酯类的有机物共有种,写出其中在核磁共振氢谱中有四个吸收峰的结构简式。
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃,101kPa时,16.0g N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是 。
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是:。电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为,
则肼-空气燃料电池理论上消耗的空气L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因。
(4)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)0.1
mol/L HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2
mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+
离子浓度由大到小的顺序为。
(1)现有反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向 方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。