图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是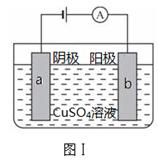

| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42—向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
下列事实一定能证明HNO2是弱电解质的是
①常温下NaNO2溶液的pH大于7;②用HNO2溶液做导电实验,灯泡很暗;③HNO2和NaCl不能发生反应;④0.1 mol/L HNO2溶液的pH=2.1;⑤NaNO2和H3PO4反应,生成HNO2;⑥0.1 mol/L HNO2溶液稀释至100倍,pH约为3.1
| A.①④⑥ | B.①②③④ | C.①④⑤⑥ | D.全部 |
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mo l/L的NaOH溶液(密度为1.2g/ml)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol(溶液中只含NaCl和NaClO两种溶质)。则下列有关说法不正确的是
l/L的NaOH溶液(密度为1.2g/ml)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol(溶液中只含NaCl和NaClO两种溶质)。则下列有关说法不正确的是
| A.原NaOH溶液的质量分数为10.0% |
| B.所得溶液中Cl-的物质的量为0.25 mol |
| C.与NaOH反应的氯气为0.15 mol |
D.所用氯气和参加反应的氢气的物质的量之比 为3 为3 ﹕2 ﹕2 |
根据碘与氢气反应的热化学方程式:
H2(g)+I 2(g) 2H I(g)ΔH=–26.48kJ·mol-1①
2H I(g)ΔH=–26.48kJ·mol-1①
H2(g)+I 2(s) 2H I(g)ΔH=+9.48kJ·mol-1②
2H I(g)ΔH=+9.48kJ·mol-1②
下列判断正确的是
A.254g I 2( g)中通入2gH2(g),反应放热26.48kJ g)中通入2gH2(g),反应放热26.48kJ |
B.反应②的反 应物总能量比反应①的反应物总能量低 应物总能量比反应①的反应物总能量低 |
| C.反应①是放热反应,说明该反应在常温下很容易发生 |
| D.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
一种充电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+ H2O + e-=Ni(OH)2+ OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
| A.H2O的还原 |
| B.Ni(OH)2的还原 |
| C.H2的氧化 |
| D.Ni(OH)2的氧化 |
如图a、b、c、d均为石墨电极,通电进行电解。下列说法不正确的是
| A.甲中a电极反应式为4OH--4e-=O2↑+2H2O |
| B.当b极有64gCu析出时,c电极产生2g气体 |
| C.电解后向乙中通入适量HCl气体,溶液组成可以恢复 |
| D.电解时向乙中滴入酚酞试剂,d电极附近变红 |