香料Ⅴ的制备方法如下:
(1)化合物I的分子式为 ,Ⅳ中含氧官能团的名称是 。
(2)化合物I可由 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为 。
(4)该工艺中第①步的目的是 。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入 ,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为 。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为 。
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2 ,其分子结构模型 如右图所示(图中
如右图所示(图中 球与球之间连线代表化学键单键或双键等。)
球与球之间连线代表化学键单键或双键等。)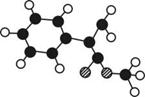
(1)根据分子结构模型写出A的结构简式__。
(2)A在酸性条件下水解生成有机物B和甲醇,B的分子式。与B互为同分异构体的C有如下结构:含苯环,含二个醛基,且苯环上只有一C = CH2CH3个支链。则C的结构简式为。
(3)从芳香烃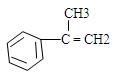 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: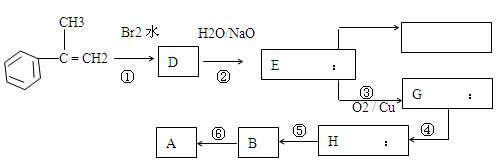
(i)写出反应类型:反应①属__反应,反应④属__反应,反应⑤属__反应。
(ii)写出反 应方程式(注明必要的反应条件)
应方程式(注明必要的反应条件)
反应②。反应⑥。
A.E.H是中学化学常见的单质;B.D.F是中学化学常见的氧化物,其中D又是生命活动不可缺少的液态物质;G.I的焰色反应呈黄色,D与 E在高温条件下能发生反应。它们之间的转化关系如下图所示: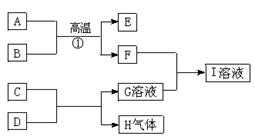
(1)C若为单质,其与D反应的离子方程式为_。C若为氧化物,其电子式为:
(2)若B为铁的氧化物,8g B灼热后通入足量CO,将生成的气体通入过量石灰水,生成沉淀15g,则B的化学式__,写出①的化学方程式。
(3)E与D反应的化学方程式。
X.Y.Z代表原子序数依次增大的三种短周期元素,在周期表中三种元素的位置相邻,且质子数之和为30。
(1)X.Y.Z三种元素能否位于同一族(填“能”或“否”),
理由是。
(2)若X.Y.Z三种元素中有金属元素,则X是(填元素符号),而Z与过量NaOH溶液反应的离子方程式为。
(3)若X.Y.Z均为主族非金属元素,由X和Y组成的化合物 A中,X和Y元素的质量比为7:16,则A可以为色的(填化学式)。
A中,X和Y元素的质量比为7:16,则A可以为色的(填化学式)。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。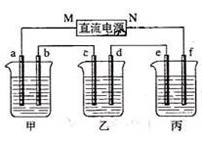
⑴、接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①、电源的N端为▲极;
②、电极b上发生的电极反应为▲;
③、列式计算电极b上生成的气体在标准状况下的体积为▲;
④、电极c的质量变化是▲g;
⑤、电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液▲;乙溶液▲;丙溶液▲。
⑵、如果电解过程中铜全部析出,此时电解▲(填“能”或“否”)继续进行,理由是▲。
用右图所示装置进行中和热测定实验,请回答下列问题:
⑴、大小烧杯之间填满碎泡沫塑料的作用是▲,从实验装置上看,图中缺少的一种玻璃仪器是▲。
⑵、使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热
△H= ▲, H2SO4与NaOH反应的热化学方程式 ▲。
⑶、实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 ▲(填“相等”、“不相等”),所求中和热 ▲(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ▲。(填“偏大”、“偏小”、“不受影响”)
⑷、若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH 1,则ΔH1与ΔH的关系为:ΔH 1 ▲ΔH(填“<”、“>”或“=”),理由是 ▲。