下表中根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 |
石灰水变浑浊 |
W可能是Na2CO3 |
| B |
蘸有浓氨水的玻璃棒靠近溶液X |
有白烟产生 |
X一定是浓盐酸 |
| C |
强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 |
先有白色沉淀, 后溶液又变红 |
Y中一定含有SO42-和Fe3+ |
| D |
少量气态炔烃Z通入pH=a的溴水中 |
溴水褪色,溶液的pH仍约为a |
Z与溴发生了取代反应 |
下列关于苯的叙述正确的是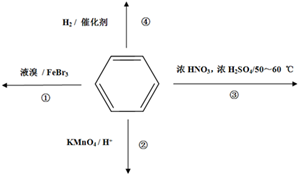
A.反应①常温下能进行,其有机产物为 |
| B.反应②不发生,但是仍有分层现象,紫色层在下层 |
| C.反应③为加成反应,产物是硝基苯 |
| D.反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
有机化合物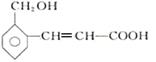 可能发生的化学反应有①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
可能发生的化学反应有①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
| A.①②③ | B.①②③④⑤ | C.①②③④ | D.①③④ |
山梨酸是一种常见的食物添加剂,它是一种无色针状晶体或白色粉末,它的结构简式为CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的是
| A.山梨酸易溶于四氯化碳 |
| B.山梨酸能与氢气发生加成反应 |
| C.1 mol山梨酸能和金属钠反应生成1 mol氢气 |
| D.山梨酸能和乙醇反应生成酯 |
下列说法不正确的是
| A.乙烯、乙醇均能使酸性高锰酸钾溶液褪色 |
| B.通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 |
| C.乙烯、环己烷都属于烃类,它们通式相同,但它们不互为同系物 |
| D.烯烃完全燃烧时,生成CO2和H2O的物质的量相等 |
使1 mol乙烯的同系物丙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是
| A.3 mol | B.4 mol | C.5 mol | D.7 mol |