某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?
。
该反应的离子方程式是: 。
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
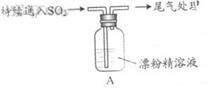 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
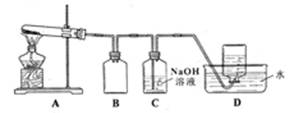
某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
⑴MgCO3的分解产物为
⑵装置C的作用是 ,处理尾气的方法为
⑶将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为
④从实验安全考虑,题9图装置还可采取的改进措施是
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;
④……⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;② 。
制备氮化镁的装置示意图如下:
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用第试剂KSCN溶液、K3[Fe(CN)6]溶液、氯水。
⑴请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
① |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ② ,振荡 |
③ |
存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硫酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 ① (填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的产物有 ② 。