推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)写出过氧化氢的电子式 。
(2)该反应的热化学方程式为 。
1mol肼完全反应转移电子数 。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)又已知H2O(l)==H2O(g);△H = +44kJ∙mol-1,由16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
按要求完成下列填空
(l)写出下列物质的电离方程式:
Fe2(SO4)3__________________________________________________,
NaHCO3______________________________________________________。
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应____________________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________________。
(3)写出与下列离子方程式相对应的化学方程式:
H++OH-=H2O __________________________________________,
CO32-+2H+=CO2↑+H2O__________________________________。
(1)同温同压下,同体积的NH3和H2S气体的质量比是___________;同质量的NH3和H2S气体的体积比是__________;同质量的NH3和H2S气体中所含氢原子个数比是___________;若两者所含氢原子个数相等,它们的物质的量比是________。
(2)Na2SO4••10H2O的摩尔质量是__________,483gNa2SO4••10H2O中所含Na2SO4••10H2O的物质的量是_______,所含Na+的物质的量是_________,所含H2O分子的数目是_______个。
在有机物分子中,不同位置的氢原子的核磁共振谱中给出的特征峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列有机物分子中,其核磁共振氢谱图中只有1个峰的物质是________。
| A.CH3—CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3COCH3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如下所示,则A的结构简式为________。请预测B的核磁共振氢谱图上有________个峰。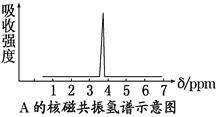
写出下列反应的化学方程式
(1) 苯的硝化反应
(2) 实验室制取乙烯
(3)乙烯与溴水反应
(4)乙烯发生加聚反应
用系统命法写出下列物质名称或结构简式
(1)2,2,3-三甲基丁烷的结构简式是
(2)1,3-丁二烯的结构简式是
(3) 的系统命名是:
的系统命名是:
(4) 的系统命名是
的系统命名是