已知某烃分子中碳元素的质量分数为82.76%,在标准状况下它的密度为2.59g/L。则:
(1)此有机物的相对分子质量为 ;
(2)此有机物的分子式为 ;
(3)若该有机物分子结构中含有2个甲基,其结构简式为 。
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是,它是由键形成的分子。(填极性或非极性)
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为,
它的VSEPR模型是 ,分子构型是 。
有以下物质:①CH4,②C2H4,③H2O,④NH3,⑤CH2O,⑥CO2;
非极性分子的是______________;既有σ键又有π键的是__________;中心原子没有孤电子对的是______________;中心原子杂化类型为sp3的是;分子构型都是直线形的是。(写序号)
第四周期元素中,4p轨道半充满的是,3d轨道半充满的是,4s轨道半充满的是。(写元素符号)
已知某元素的原子序数是26,试推测:
(1)该元素的简化电子排布式为;
(2)该元素处在周期族;
(3)该元素的常见化合价是。
某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题: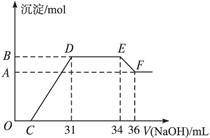
1、图中OC段没有沉淀生成,此阶段发生反应的离子方程式为。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
2、B与A的差值为______________mol。
3、B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
4、求原硝酸溶液的物质的量浓度?